
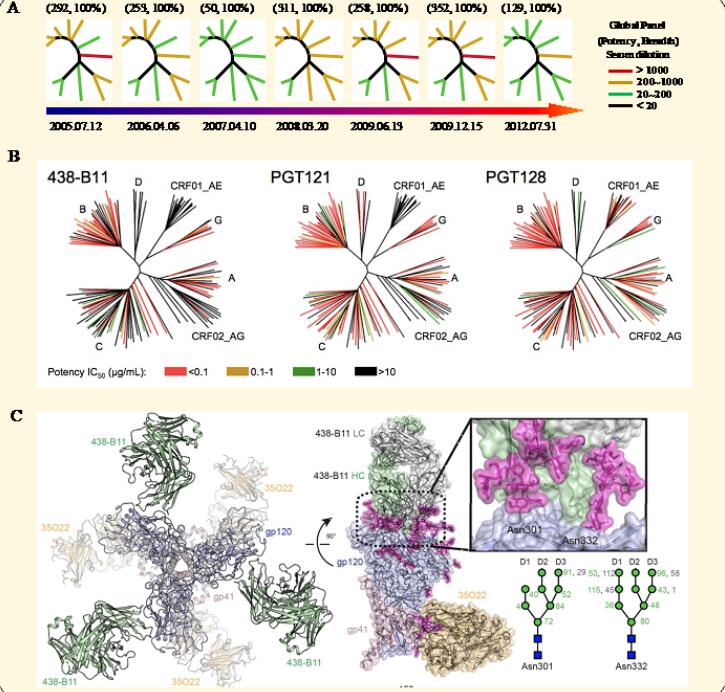
艾滋病困扰人类已有三十余年,由于病毒变异大,病毒包膜蛋白表面高度糖基化和构象遮蔽阻止中和表位识别,加之对艾滋病毒感染的免疫保护机制缺乏清晰认识等,至今尚无可供预防使用的有效艾滋病疫苗问世。 诱导产生能中和不同亚型病毒的广谱中和抗体是有效疫苗的重要目标,目前为止尚未研发出能诱导产生广谱中和抗体应答的艾滋病疫苗,但多年的研究已经发现,在艾滋病毒自然感染过程中,有部分感染者能够产生针对膜蛋白保守区的广谱中和抗体,这些广谱中和抗体一般在病毒感染多年后出现,能以极低浓度中和大部分艾滋病毒株,对这些广谱中和抗体的分离鉴定及其产生机制的探索可为有效艾滋病疫苗设计提供科学依据。 近日,中国疾病预防控制中心邵一鸣团队、美国Scripps研究所Ian A. Wilson团队和朱江团队,合作从中国HIV-1感染者中分离出2株能够高效抑制病毒的单克隆广谱中和抗体438-B11和438-D5(图1),重链基因来源于IGHV1-69谱系,突变率和CDR3长度分别为25%和21aa,轻链来源于IGKV3-20,突变率和CDR3长度分别为13%和9aa。在一个包含了129个不同亚型病毒的HIV-1假病毒盘上,438-B11能够中和其中的41.9%,平均中和强度仅为0.027 μg/ml。晶体结构显示438-B11以一种独特的接近角度识别病毒的V3聚糖表位,HCDR3内部的二硫键对该抗体的结合和中和至关重要。无偏移抗体组库分析描绘了438-B11/D5所在家系抗体的动态演化过程,该家系抗体可在病人体内快速发展成熟。该研究分离到2株独特表位的抗HIV-1广谱中和抗体,阐明了其抗病毒作用机制,为靶向该V3聚糖区域的艾滋病疫苗设计提供了基础。 该研究结果于9月16日发表于《Science Advances》杂志,中国疾病预防控制中心邵一鸣研究员、美国Scripps研究所Ian A. Wilson教授和朱江副教授为该论文的共同通讯作者。Sonu Kumar博士(Scripps研究所博士后)和鞠斌博士(中国疾病预防控制中心和南开大学联合培养博士后,现为深圳市第三人民医院助理研究员)为该论文的共同第一作者。该研究获得了国家科技重大专项、博士后创新人才支持计划和美国NIH基金等资助。 图1. 抗HIV-1单克隆广谱中和抗体438-B11的分离鉴定 A 感染者血浆样本中和能力检测; B 抗体438-B11中和能力检测; C 抗体438-B11-gp120复合物晶体结构解析
【责任编辑:高翔 邮箱:freewebmaster@163.com】



