
上周在墨西哥举行的第十届国际艾滋病学会艾滋病科学会议(IAS 2019)上发表的一份报告显示,新型的艾滋病毒附着抑制剂fostemsavir在一半以上有广泛的既往治疗经验和高度耐药病毒的人中继续保持病毒抑制。研究参与者,其中许多人在基线时有较高的免疫抑制,CD4细胞经历了大量增长。
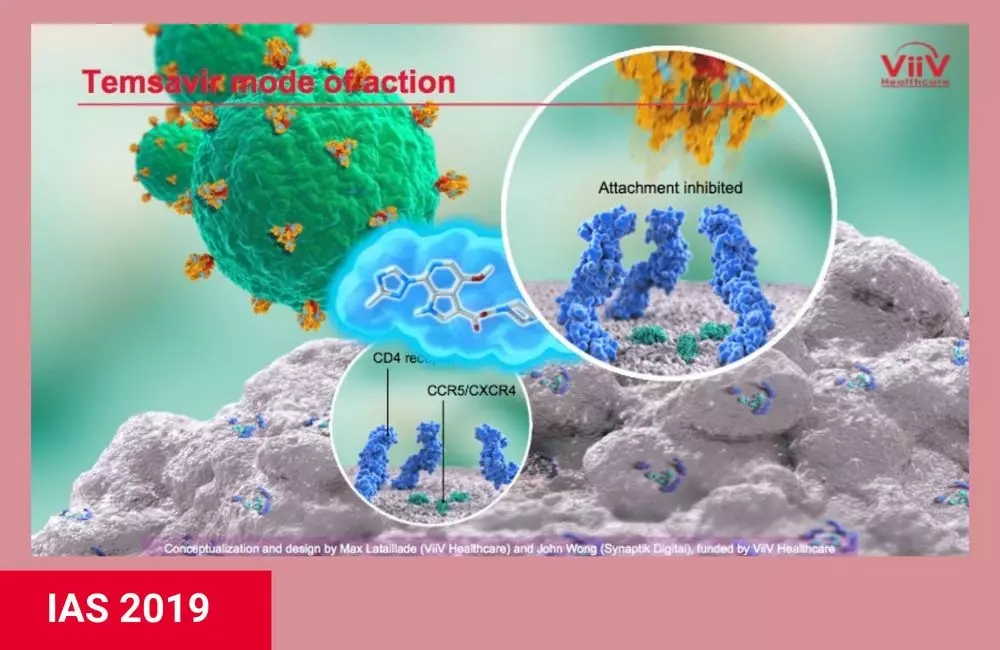
Fostemsavir是第一种可防止HIV附着于宿主细胞的口服抗逆转录病毒药物。它的活性成分称为Temsavir,与构成病毒表面尖峰的HIV包膜蛋白gp120部分结合。这可以防止病毒附着在T细胞和其他免疫细胞上的CD4受体上,从而防止病毒进入细胞。(可注射药物恩福韦肽[fuzeon]与HIV包膜蛋白的gp41部分结合。) ViiV Healthcare的Max Lataillade博士介绍了第3阶段Brighte研究的最新发现,Brighte研究是一项正在进行的试验,评估Fostemsavir在治疗经验丰富的多药严重耐药艾滋病毒患者中的作用,这些患者无法使用现有药物构建有效的抗逆转录病毒治疗方案。 该研究的随机部分包括272名参与者,他们使用未抑制病毒的失败方案(至少400拷贝/ ml)。他们被分配每天两次服用600毫克的fostemsavir或安慰剂,以及接受8天的失败方案。在那之后,每个人都接受了fostemsavir加上一个优化的治疗方案,该方案包含了对他们最有效的药物。所有参与者必须有一到两个剩余的抗逆转录病毒药物类别,至少有一个完全有效的批准药物;Dolutegravir仍然有效约65%。 在这个队列中,大约四分之三的人是男性,大多数是白人,平均年龄为48岁;60%的人超过50岁。大多数病毒载量在1000至100000份/ml范围内,但29%的病毒载量超过100000份/ml。CD4计数的中位数为99个细胞/mm3,72%的少于200个细胞/mm3,26%的少于20个细胞/mm3。大多数人有艾滋病史。 此外,99名没有完全有效的治疗药物的患者被纳入了一个非随机的队列。该组可在其优化方案中使用其他研究药物,如ibalizumab单抗(该药物自美国批准为Trogarzo,最近得到了欧洲药品管理局的积极肯定)。这个队列在人口统计学上相似,但有更先进的免疫抑制,CD4计数中位数为40个细胞/mm3。 正如2017年欧洲艾滋病会议上报道的,fostemsavir作为功能性单一疗法在前8天比安慰剂更能降低病毒载量。Lataillade在墨西哥城说,基线病毒载量高于1000拷贝/ml的受试者的HIV RNA平均下降了1.0 log10,尽管他之前报告下降为0.8 log10。 在去年的格拉斯哥国际艾滋病药物治疗大会上,Lataillade发表了为期48周的研究结果。在这一点上,54%的受试者随机接受fostemsavir治疗,38%的非随机队列患者达到了病毒抑制(<40拷贝/ml)。 在意向治疗分析中,到96周,病毒抑制的随机患者比例上升到60%。由于疗效原因而改变其优化背景方案的患者被纳入30%的病毒学失败患者中。另外10%的受试者因停药或死亡而没有病毒学数据。在观察或治疗分析中,病毒抑制率较高,79%的病毒抑制率低于40拷贝/ml,88%的病毒抑制率低于400拷贝/ml。 在非随机队列中,通过意向性治疗分析,96周病毒抑制率稳定在37%。在这里,43%的患者经历了病毒学失败,19%的患者没有病毒学数据。在观察的分析中,59%的人的HIV RNA低于40拷贝/ml,68%的人的HIV RNA低于400拷贝/ml。 病毒载量的降低伴随着CD4计数的提高。在随机队列中,96周时的平均增益为205个细胞/mm3,比48周增加66个细胞/mm3。基线时小于20个细胞/mm3的患者出现最大改善(240个细胞/mm3)。在71名基线水平低于50个细胞/mm3的患者中,56%的患者在96周时至少有200个细胞/mm3,这是AIDS诊断的门槛,并且增加了机会性感染的风险。平均CD4-CD8细胞比率也上升了。在非随机队列中,平均CD4增加119个细胞/mm3。 治疗继续是安全的和良好的耐受性。观察两组患者,21%出现药物相关的中重度(2-4级)副作用,3%出现药物相关的严重不良事件,7%因不良事件停止治疗。最常见的不良事件是恶心、腹泻和头痛。此外,在这一免疫功能严重受损的人群中,有38(10%)例艾滋病确诊事件和29(8%)例死亡;除6例死亡外,其余死亡均发生在细胞/mm3小于50的人群中。 研究人员总结说:“尽管在这一难以治疗的人群中持续消耗,但病毒学反应随着时间的推移持续改善。”Brighte的研究结果支持Fostemsavir作为一种重要的治疗方案的持续开发,该治疗方案适用于患有多重耐药HIV-1的患者。” Lataillade说,这些研究结果表明,fostemsavir对于艾滋病病毒感染者和低CD4患者来说可以改变生活。 对于倡导者提出的问题,他承认,Fostemsavir早期准入计划(EAP)受到限制,美国食品药品监督管理局(FDA)的申请因制造问题而推迟。然而,据Lataillade说,最近两个新的制造工厂已经完工,VIIV预计将能够重新启动EAP,并希望在今年年底之前提交给FDA审批。
参考资料 Lataillade JM et al. Week 96 safety and efficacy of the novel HIV-1 attachment inhibitor prodrug fostemsavir in heavily treatment-experienced participants infected with multi-drug resistant HIV-1 (BRIGHTE study). 10th International AIDS Society Conference on HIV Science, Mexico City, abstract MOAB0102, 2019.
【责任编辑:高翔 邮箱:freewebmaster@163.com】



