
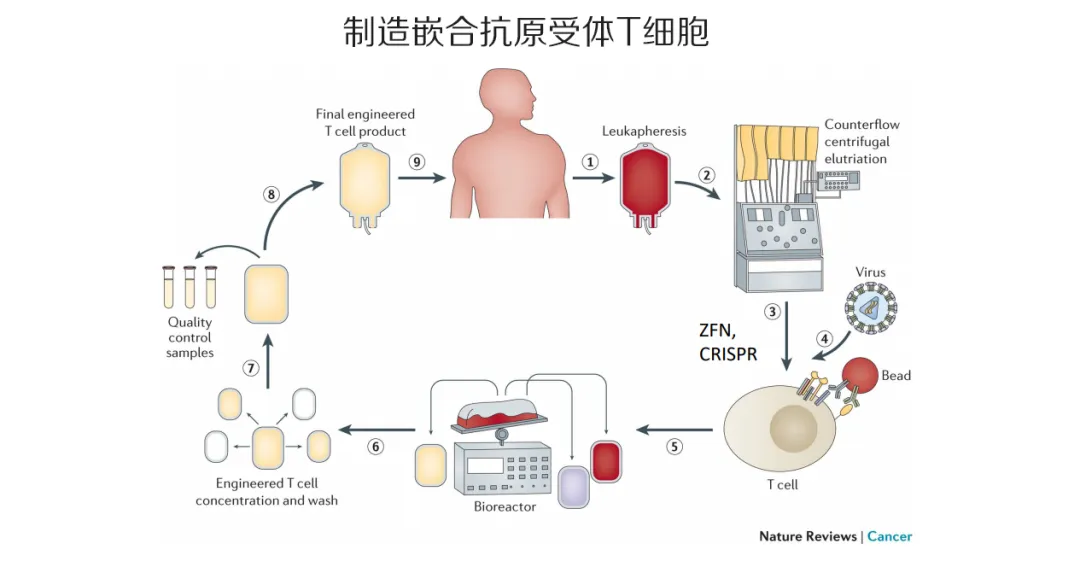
在最近的逆转录病毒和机会性感染会议(CROI 2020)上,报道了采用两种不同的方法来治愈HIV产生了诱人的新数据。 哈佛医学院的资深HIV研究人员Dan Barouch教授介绍了结合三种不同疗法治疗猴子的研究结果: 免疫刺激剂vesatolimod可以激活出尽可能多的被病毒感染的细胞,使其不再静默。 广谱中和抗体(bNAbs)以尽可能多地靶向并杀死它们。 一种治疗性疫苗,可进行长期的免疫监视,以清除残留感染细胞产生的任何残留具有复制能力的病毒。 Barouch是Martin Delaney Cure治疗免疫疗法的主要研究者,该组织是由美国国家过敏和传染病研究所资助的六个研究联盟合作伙伴之一,是以艾滋病活动家和信息工程的创始人Martin Delaney的名字命名的,他于2009年去世。 Delaney的另一个合作伙伴是BEAT-HIV,它专注于基因治疗,即使用改变细胞基因核心的技术,从而完成他们能做的“工作”。宾夕法尼亚大学的吉姆莱利(Jim Riley)博士介绍了这个令人兴奋的领域研究成果:细胞工程使它们对HIV免疫,诱导它们制造自己的病毒阻断化合物,甚至还引入了完全“重新设计”的T细胞,即所谓的嵌合抗原受体(CAR)细胞,它们对艾滋病病毒产生比自然界更有效的免疫反应。 结合抗体、免疫刺激剂和疫苗 Barouch的研究将vesatolimod、bNAb和治疗性疫苗结合起来,首先用人工剪接病毒SHIV感染51只恒河猴。九天后,他们开始接受抗逆转录病毒疗法(ART)。 在完全抑制性ART治疗六个月后,51只猴子中的24只在两种不同的载体(两种病毒的外壳称为ad26和MVA,以前都用于人体试验)中接种了含有SHIV基因的治疗性疫苗。大约六个月后,51只猴子中的36只(包括24只接受疫苗的猴子)开始了一个10剂免疫刺激剂vesatolimod(以前称为GS-9620)的疗程。此后大约三个月,24只猴子(包括已接种疫苗的12只猴子)也开始了每两周输注5次广泛中和抗体(bNAb)PGT121的过程。 这意味着15只猴子只接受了安慰剂治疗。 12只接受了vesatolimod和PGT121治疗; 12只接受了vesatolimod和ad26 / MVA疫苗; 12只接受了全部三种治疗方案。 在最后一次使用vesatolimod的猴子最后一次抗体输注后大约三个月(首次感染后一年零八个月),停止ART并在接下来的4.5个月内跟踪猴子的病毒载量。 给予安慰剂的15只动物的病毒载量全部反弹(重新出现)。病毒最大负荷发生在ART停止后两周,范围从数千到数百万个拷贝/ 毫升。ART停止后的12周,这些猴子的病毒载量平均已降至2000拷贝/ 毫升的稳定状态,其中三个超过10,000拷贝/ 毫升,另一个超过100,000拷贝/ 毫升。 相比之下,在接受ad26 / MVA疫苗加vesatolimod的12只猴子中,病毒载量也全部反弹,但均达到较低的平均水平(约200拷贝/ 毫升,没有一个高于2000拷贝/ 毫升)。但是,其中的三只猴子重新抑制了病毒,并在停止ART后四,六和八周分别发现了不可检测的病毒载量,并在12周时保持了这种状态。 在12只给予vesatolimod加PGT121 bNAb的猴子中,其中四只猴子的病毒载量根本没有反弹,或者直到12周时才反弹。其余8只猴子的病毒载量峰值平均在2000拷贝/ 毫升左右,并有所延迟,该峰值在停药后三至六周之间。然而,稳态病毒载量与安慰剂动物相比并没有减少很多。 在会议召开时,接受所有三种疗法的12只猴子中,10只获得了结果。在其中的4只病毒载量根本没有反弹,另外2只在第六周和第十二周时重新抑制了它们的病毒载量,因此到那时,10只猴子中有6只病毒载量不可检测。在有4只病毒载量反弹但没有重新抑制,第12周的平均病毒载量约为1000拷贝/ 毫升。 另一项研究(Prague)汇总了该研究以及对相同三种疗法的其他几项研究的结果,例如2018年报道的这项研究,并研究了这三种成分对病毒抑制的成果。 单独使用时,该疫苗可将潜伏病毒的再激活抑制到安慰剂的25%。当与vesatolimod组合使用时,它可以将抗病毒免疫反应的亲和力提高17倍和210倍。bNAb将免疫应答的亲和力提高了8倍,但将其与vesatolimod结合使用则未显示出进一步的协同作用(它们对免疫应答的刺激作用不如单独作用更强)。 如果这些结果在人类中得到复制,则单独使用vesatolimod,vesatolimod +疫苗和vesatolimod +bNAb有望导致病毒反弹控制在大约5%,55%和90%的患者。但是,这通常是在高峰病毒载量之后,并且预期结果在个体之间会有很大差异。 在主要会议上,Gilead Sciences的Devi SenGupta博士在初步的安全性和病毒反弹研究中介绍了仅在人体内使用vesatolimod的第一个结果。 在这项研究中,对17名接受抗逆转录病毒治疗的艾滋病毒患者每两周使用10剂vesatolimod,另外8名接受安慰剂。他们都必须是“艾滋病毒的部分控制者”,这意味着他们开始抗病毒治疗前的平均病毒载量不得超过5000拷贝/ 毫升。vesatolimod疗程结束后,停药,六周后重新开始治疗,如果病毒载量在停药后仍被持续抑制在200以下,可能延迟重新治疗。参与者的平均年龄为45岁,其中25位女性中有4位是接受抗病毒药治疗的平均时间为三年,开始抗病毒治疗前的平均病毒载量为1585拷贝/毫升。 Vesatolimod作为一种免疫刺激剂,引起了一些副作用:发冷,头痛以及淋巴结肿大。平均而言,从安慰剂治疗的四周到药物治疗的五周,病毒载量反弹的时间略有增加,但在统计学上显着增加,超过200拷贝/ 毫升。 但是,正如在这些治愈试验中经常看到的那样,一部分参与者的反应更为强烈,其中四名参与者在6周内没有病毒载量反弹至50以上,而另一名参与者直到第15周才反弹。该人花了31周的时间才能达到任何病毒载量超过200拷贝/ 毫升,并且实际上在研究的剩余六个月中一直不使用ART,病毒载量在164和215拷贝/ 毫升之间变化。 基因疗法可以使细胞对HIV免疫或对其过度反应 莱利在Cure研讨会上概述了基因工程领域的最新研究。 我们现在知道的两个被治愈艾滋病毒的人- 蒂莫西·雷·布朗(Timothy Ray Brown)和亚当·卡斯蒂列霍(Adam Castillejo) –部分原因由于基因改变而治愈了他们。两者都进行了细胞移植,该细胞缺乏关键CCR5受体,而这种受体通常是病毒进入细胞所必需的。 供体自然缺乏CCR5受体的人很少,而基因疗法则可以使用技术来人工创建此类细胞。它使用诸如锌指核酸酶(ZFN)或CRISPR-Cas9的分子工具,这种基因编辑技术可以从细胞内外去除或插入基因序列。这些基因编辑技术仅在15年前就被用作一种基因研究工具,而在不到10年前就被用于HIV。2011年报道了第一个从HIV感染者中编辑CCR5基因的实验。 基因编辑作为一种技术,在癌症治疗中比在HIV中先进得多。莱利说,对clinicaltrials.gov数据库的搜索显示,针对艾滋病毒感染的基因疗法仅进行了7项临床试验,而癌症研究则为711项。 部分原因是因为我们已经有了控制HIV的疗法,HIV基因编辑技术必须特别安全,但是科学家可以冒更大的风险来提高原本致命的癌症的存活率。正如莱利所说,艾滋病毒是“要达到更高要求的成果”,因为它已经是可以控制的疾病。当他被问及一次可能花费100,000美元的治疗是否具有成本效益时,他的回答是,癌症治疗研究将导致对HIV有效的疗法,而且随着它们变得越来越普遍,它们将变得更便宜。 他说:“我们现在可能正处于开发大型计算机以治愈艾滋病的时代。在20至30年的时间里,我们可能会拥有计算系统。” 然而,这七项HIV基因疗法研究旨在做杰出的贡献。 一项研究使用了一种称为CAL-1的分子干预措施,它不仅可以使骨髓和白细胞的CCR5受体失活,还可以诱导细胞产生一种融合抑制剂,从而有效地抵抗HIV感染。 两种技术可产生抗HIV的CD34 +细胞。这些是造血干细胞,通常仅生活在胎儿的骨髓或脐带深处,并多样化进入免疫系统细胞的整个库。目的是看通过改变这些方法是否可以开发出完整的抗HIV T细胞系统。 我们已经报道了另一项计划:开发一种疫苗,该疫苗包含细胞的遗传学指示,以制造广谱中和针对HIV的抗体。 莱利参与了两个研究计划。一个继续进行这一程序,以产生抗CCR5的CD4细胞并将其“移植”到人们的免疫系统中。 另一个涉及制造所谓的嵌合抗原受体T细胞– CAR细胞。这项技术通过诱使它们展示可识别HIV的细胞受体,从物理上改变了对HIV无反应的T细胞(即使在HIV感染者中也没有)。然后,这些细胞会产生与自然界不同的抗HIV免疫反应,而HIV没有对此产生免疫力。希望这种细胞可以形成对HIV“超强免疫反应性”的细胞群,从而可以在病毒开始压倒自然免疫反应之前终止感染。 这两种技术都是通过从艾滋病毒感染者身上提取T细胞,并使用上述工具(例如ZFN和CRISPR-Cas9)对它们进行遗传改造,然后将T细胞重新注入同一患者体内来完成的。 这两种方法的难点在于可以制造的T细胞数量。莱利说:“在使用自体工程化T细胞的第一个实验中,我们制造了约100亿个缺少CCR5受体的T细胞。但是,您体内大约有5000亿个T细胞。这大约是2%。与蒂莫西·雷·布朗(Timothy Ray Brown)这样的人的情况大不相同,因为他的T细胞100%CCR5阴性,因为他进行了骨髓移植,从而替代了所有的细胞。 问题不仅在于您可以制造多少个改变的T细胞,而且还可以植入多少个。换句话说,在人体内所有T细胞中,被改变的比例是多少,以及它们是否能够持久甚至增殖。 尽管如此,即使在涉及从T细胞中删除CCR5受体然后重新注入它们的最早的实验之一中,也观察到一种模式,即在停止ART时,接受者往往具有较慢的病毒载量反弹。更令人惊讶的是,该研究中所有六名患者的病毒载量在治疗中断的第5-7周达到峰值,然后在撤回ART的其余12周中开始下降。一名参与者再次变得不可检测。 分析了该患者的基因后,发现它们是CCR-5杂合的。也就是说,他们的父母一方缺少CCR5基因,因此他们只有CCR5基因的通常补体的一半,而T细胞受体较少。 在这项技术的最新研究中,宾夕法尼亚大学团队将CCR5阴性的自体T细胞重新注入了13名志愿者中。在其中十名志愿者中,他们还向他们注射了一定剂量的免疫抑制剂药物环磷酰胺,然后再注入T细胞。六名志愿者是杂合子,只有一个CCR5基因拷贝(如果您有两个拷贝,则该术语是纯合子)。他们还改变了环磷酰胺的剂量。 莱利评论说,总体结果令人失望。尽管达到反弹时病毒载量达到峰值所需的时间比对照组要长(p = 0.03),但实际上只延迟了1-2周。在对照组中,队列反弹达到50%的时间为3周,纯合子参与者为4周,杂合子参与者为5周。 然而,在三名参与者中,在接受抗逆转录病毒治疗期间,病毒载量再次下降,一名志愿者被短暂地检测不到,一名在发展为约1000拷贝/ 毫升的长期病毒载量之前几乎被发现,另一名病毒载量保持在约1000拷贝/毫升。很长一段时间。莱利说,它们的病毒载量无法预测地“反弹”,这暗示着细胞植入过程中发生了动态过程。三名病毒载量反弹的患者中T细胞改变的比例最高,约占其总补体的1.44%。 莱利团队的下一个阶段是,将这些CCR5耗尽的T细胞与CAR T细胞结合起来。如上所述,这些是经过基因工程改造的T细胞,可在其表面上显示对HIV高度敏感的受体分子,并显示出与天然形成的HIV-1特异性T细胞不同的免疫应答模式。 在小鼠实验中,给予一种CAR T细胞的动物因治疗中断而产生的病毒载量比对照组小鼠低2个对数(100倍)。 在CROI(Rust)上进行的一项研究中,4只接受CAR T细胞的猴子在停药后经历了病毒反弹的延迟,其中一只在停药七周后仍未被发现。 在人体试验中,一旦注入CCR5耗尽和CAR T细胞的组合,一个组就可以停止其ART治疗。在另一组,抗逆转录病毒治疗的中断将延迟八周。 本文参考: Watch Dan Barouch's video on YouTube. Watch Jim C Riley's video on YouTube. Abstracts presented at the main conference mentioned in this piece are as follows: Barouch D et al. Combined active and passive immunization in SHIV-infected rhesus monkeys.Conference on Retroviruses and Opportunistic Infections, abstract 78, March 2020. View the abstract on the conference website. Watch the webcast on the conference website. Prague M et al. Viral rebound kinetics following single and combination immunotherapy for HIV/SIV. Conference on Retroviruses and Opportunistic Infections, abstract 320, March 2020. View the abstract on the conference website. View the poster on the conference website. SenGupta D et al. Safety and analytic treatment interruption outcomes of vesatolimod in HIV controllers. Conference on Retroviruses and Opportunistic Infections, abstract 40, March 2020. View the abstract on the conference website. Watch the webcast on the conference website. Rust B et al. Chimeric antigen receptor T-cells control SHIV replication in post-ATI macaques. Conference on Retroviruses and Opportunistic Infections, abstract 76, March 2020. View the abstract on the conference website. Watch the webcast on the conference website.
【责任编辑:高翔 邮箱:freewebmaster@163.com】



