

背景介绍
本文原题为“随访研究:针对致病性SHIVSF162P3CN挑战后,基于PD-1的DNA疫苗接种使恒河猴实现了6年无cART病毒学控制”,作者为何晓恩 、黄亦春 、钟梦龙(音译)等人。新华社香港2024年1月31日也报道了这一进展。原文章2023年12月12日发布在《Microbiology Spectrum》上,"Microbiology Spectrum" 是一个同行评审的科学期刊,专注于微生物学领域的研究。
该期刊由美国微生物学会(American Society for Microbiology, ASM)出版,涵盖了微生物学各个方面的最新发现和进展,包括但不限于细菌学、病毒学、真菌学、寄生虫学、微生物生态学、免疫学、以及微生物与宿主之间的相互作用。
这篇文章主要介绍了一项关于基于PD-1的DNA疫苗(pRhPD1-p27)在恒河猴中对抗SHIV(一种模拟HIV的病毒)感染的研究。通过长期跟踪研究,发现这种疫苗能够在恒河猴体内激发强大的、针对病毒的T细胞免疫反应,从而实现不依赖传统抗逆转录病毒治疗(cART)的病毒控制。
研究中还探讨了携带特定MHC-I基因等位基因(Mamu-B*017)的恒河猴对疫苗的响应,以及这种疫苗潜在的人类临床应用前景。此外,文章还对实验数据进行了统计分析,以验证研究结果的显著性。总的来说,这项研究为开发新型治疗性艾滋病疫苗提供了有希望的策略和初步证据。

导言
摘要:为了应对艾滋病大流行,研发了一种能够增强特定抗原反应的CD8+ T记忆细胞,从而在不使用传统抗逆转录病毒治疗(cART)的情况下控制HIV-1病毒的有效疫苗。在之前的研究中,我们发现,一个名为pRhPD1-p27的基于PD-1机制的DNA疫苗成功激活了特定的Gag-p27记忆细胞,这些细胞能在恒河猴体内抑制致病性的SHIVSF162P3CN病毒,效果持续了两年。
在最新的后续研究里,我们观察到两只接种了pRhPD1-p27疫苗并感染了该病毒的恒河猴,六年来在未接受cART治疗的情况下依然存活,且病毒量几乎检测不到,展现了长期病毒控制的效果。这些恒河猴体内保持了对抗Gag-p27的多功能记忆T细胞反应。更值得注意的是,我们发现,即使在病毒挑战六年后,部分T细胞反应与疫苗接种期间的反应一致,说明疫苗激发的记忆细胞反应具有长期稳定性。
同时,这些恒河猴还产生了新的针对Nef的T细胞反应,并得以保持。与某些经过特殊抗体治疗控制病毒的恒河猴相比,这些针对Gag-p27和Nef的T细胞反应更为强烈。我们的研究结果显示,基于PD-1机制的DNA疫苗作为一种长期控制HIV-1的免疫治疗方法,展现出了极大的潜力。
重点:要想结束艾滋病的大流行,找到一种有效的不依赖传统抗病毒治疗的HIV-1病毒控制方法非常关键。效应记忆型CD8+ T细胞在抑制病毒和消灭病毒感染的细胞方面发挥着至关重要的作用,因此它们成为了疫苗研发中极有潜力的目标。
先前的研究已经显示,通过PD-1机制的DNA疫苗能够有效地激活多功能的效应记忆CD8+ T细胞,这对于控制艾滋病毒非常有效,而且在恒河猴身上的效果能持续两年。我们最新的研究进一步深化了这些发现,展示了两只接种了针对特定病毒SHIVSF162P3CN的PD-1机制DNA疫苗的猴子,在没有接受抗病毒治疗的情况下,超过6年时间里都没有出现病毒活动。
我们还发现了长期的疫苗引发的记忆T细胞反应。这些结果为将基于PD-1的DNA疫苗用于临床试验提供了强有力的支持,这种疫苗旨在实现不依赖传统治疗的HIV-1病毒控制,可以单独使用,也可以与其他治疗手段结合应用。
到目前为止,为了预防和减少艾滋病的传播,科学家们使用了一种叫做结合抗逆转录病毒治疗(cART)的方法,这种方法既可以在人们还没接触到HIV病毒之前预防(PrEP),也可以在接触到病毒之后防止感染(PEP),这大大降低了艾滋病的死亡率和HIV的传播。
但是,即使是这样有效的治疗方法,也无法完全根除HIV,因为HIV病毒能在体内形成一个难以触及的潜伏库,这使得完全不依赖cART治疗而控制HIV感染成为了自80年代发现艾滋病和HIV以来的巨大挑战。而且,HIV病毒种类繁多,能够变异抵抗现有的药物,这不仅让病毒控制变得更加困难,也给疫苗的开发带来了挑战。
因此,科学界正寻找新的疫苗策略,比如能够广泛中和病毒的抗体和能够广泛响应不同HIV变种的T细胞反应,这些都是对抗HIV/艾滋病大流行的新武器。
目前,有许多HIV-1疫苗候选正在接受实验室测试和人体试验阶段。不过,一些试验因为在预防HIV方面效果不佳而被迫停止,这包括了HVTN702/Uhambo、HVTN705/Imbokodo和HVTN706/Mosaico三个项目。特别在HVTN702研究中,研究人员发现CD4+ T细胞的反应比CD8+ T细胞的反应更为显著。
为了更好地激发对病毒的CD8+ T细胞反应,科学家们发现巨细胞病毒(CMV)是一个很有希望的疫苗载体,可以用来传递病毒抗原,从而在猴子身上长期控制猿免疫缺陷病毒(SIV)。但是,使用CMV作为疫苗载体的安全性、免疫原性和有效性在人体中的效果还需要进一步的研究确认。
除了预防HIV感染,HIV-1疫苗还有可能被用于治疗,目的是在不需要终身使用抗逆转录病毒治疗(cART)的情况下,实现对HIV的长期控制,即在感染者体内持续抑制病毒的活动。
我们的研究团队开发了一种新型疫苗技术,这种技术基于一种叫做程序性死亡-1(PD-1)的机制。这种疫苗通过DNA质粒(一种小的DNA分子)来携带重组抗原,这些抗原是通过将目标病毒或病原体的关键部分与一种可溶性PD-1区域结合来设计的。
通过小鼠实验,我们发现这种设计让疫苗能特别有效地锁定树突状细胞,这是身体中重要的免疫反应启动者。更重要的是,与传统疫苗相比,这种PD-1基础的DNA疫苗在激发强大的多功能效应记忆CD8+ T细胞反应方面展现出了优越的免疫原性和保护效能,有效对抗了病毒感染和肿瘤的形成。
我们最近完成了一项针对恒河猴的研究,这项研究探索了一种新型的基于PD-1机制的DNA疫苗对抗一种称为猿-人类免疫缺陷病毒(SHIV)的能力。这种疫苗,名为pRhPD1-p27,通过将一种特殊的抗原(SIV Gag-p27)与恒河猴体内的一种可溶性PD-1蛋白结合,成功地在接种的恒河猴体内引发了强大的、多功能的效应记忆CD8+ T细胞反应,这种反应对抗了一种有害的SHIVSF162P3CN病毒挑战,实现了长期的病毒控制。
在四只接受了pRhPD1-p27疫苗接种的恒河猴中,我们观察到它们在两年内保持无病毒状态,这表明通过使用这种基于PD-1的DNA疫苗,我们可能不需要依赖传统的抗逆转录病毒治疗(cART)就能控制病毒。了解这种疫苗能够达到的病毒抑制程度对于开发无需cART的HIV-1控制策略至关重要。在这项后续研究中,我们继续观察了这些猴子在接受SHIVSF162P3CN挑战六年后的病毒水平和T细胞免疫反应情况。
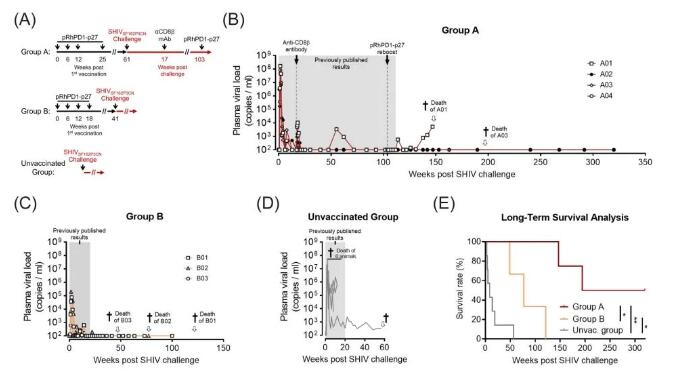
图1 在一项研究中,科学家们观察了接种了pRhPD1-p27疫苗并面临SHIV挑战的恒河猴的长期病毒控制能力。实验被分成了几个组:A组的四只猴子接种了三次PD-1基疫苗,每次间隔六周,并在25周后接受了一次增强接种。B组的三只猴子则是接种了四次疫苗,也是每六周一次。还有一组未接种疫苗的猴子,作为对照组。所有的猴子在实验中的某个时刻被用SHIVSF162P3CN病毒挑战,随后科学家们定期检测它们的血浆病毒量。特别地,在A组,猴子在病毒挑战后的第17周接受了一种名为CD8b255R1的抗体处理,并在挑战后的第103周再次接种了pRhPD1-p27疫苗。研究结果显示,在病毒挑战后,无论是A组还是B组的猴子,它们的血浆病毒量都被成功控制,直到实验结束(达到320周)。而未接种疫苗的对照组猴子则表现出较高的病毒量。此外,接种了pRhPD1-p27疫苗的猴子(A组和B组)与未接种疫苗的猴子相比,存活时间显著更长,这通过对数秩检验进行了验证。这项研究突显了pRhPD1-p27疫苗在长期控制SHIV病毒和提高生存率方面的潜力。
研究结果
在未使用传统的抗HIV治疗(cART)的情况下,两只接受了pRhPD1-p27疫苗接种并感染了SHIVSF162P3CN病毒的恒河猴成功维持了长期的病毒不可检测状态
在这项研究中,我们检测了三组来自中国的恒河猴:A组的四只猴子通过肌肉注射和电穿孔技术接种了四次疫苗,间隔时间为6至13周;B组的三只猴子也采用同样的方法接种了四次,每次间隔6周;同时,还有九只未接种疫苗的猴子作为对照组。
所有猴子都通过静脉注射接受了一种特定的SHIVSF162P3CN病毒挑战。随后,我们对它们进行了一系列病毒学和免疫学的跟踪分析。特别地,A组的猴子在感染后的第17周接受了一种特殊的抗体处理,并在103周后再次接种了疫苗。
直到我们的研究报告期结束,A组的四只猴子在病毒挑战后长达两年的时间里成功抑制了病毒载量(以灰色高亮显示之前的研究结果)。根据最初的研究,B组的猴子在病毒挑战后20周的观察期结束时,病毒载量也达到了不可检测的水平。
然而,对照组中的大多数未接种疫苗的猴子在这段时间内病毒载量超过了104 RNA拷贝/mL,由于健康状况严重恶化(包括显著的体重减轻和持续性腹泻),有67%的猴子不得不被安乐死。
我们继续追踪了恒河猴在病毒挑战后长达六年的健康状况。在我们这次的研究中,原本九只未接种疫苗的恒河猴中有两只被转用于其他研究,因此我们只跟踪了剩下的七只。在这七只中,仅有一只在最初报告的20周后仍然存活。
这只猴子随后表现出持续的低病毒量,但在60周后未能生存下来。在接种了疫苗的B组中,所有猴子至少活到了49周。但由于健康状况恶化,B03、B02和B01分别在49、77和121周被安乐死。值得注意的是,B02和B03在被安乐死时血浆中未检测到病毒,这表明它们的健康恶化可能与SHIVSF162P3CN感染无关。同样,B01在100周时收集的血浆样本中也未检测到病毒。
在接种疫苗的A组,A01和A03因健康问题分别在146和194周被安乐死。A01在死前出现病毒反弹,而A03在死前未检测到病毒,不幸的是因其他原因去世。然而,A02和A04至今仍然存活,这让我们有机会进行更长期的跟踪研究。
我们发现,在没有任何传统抗HIV治疗的情况下,这两只猴子在病毒挑战后超过327周都维持了不可检测的病毒量,并在291至327周之间显示出CD4+ T细胞数量和CD4+/CD8+比率上升的趋势。
统计显示,接种pRhPD1-p27疫苗的猴子比未接种疫苗的猴子有显著的生存优势。这些结果表明,PD-1基疫苗在没有传统治疗的情况下,有效延长了生存时间,并抑制了SHIVSF162P3CN的复制。
在病毒挑战六年后,我们在两只接种了pRhPD1-p27疫苗并感染了SHIVSF162P3CN病毒的存活恒河猴体内发现了多功能的效应记忆型抗原特异性T细胞
我们之前的研究已经表明,pRhPD1-p27疫苗激发的CD8+ T细胞反应对于控制SHIV病毒的复制至关重要。通过进行干扰素-γ(IFN-γ)ELISpot实验,我们初步确定了所有A组恒河猴在病毒挑战122周后的Gag-p27和Nef特异性T细胞。
在这个关键时刻,恒河猴A01在即将发生病毒反弹之前并没有显示出任何病毒特异性T细胞反应。相反,在其他三只A组的恒河猴中,我们检测到了Gag-p27和Nef特异性T细胞的反应。因此,病毒的反弹与抗病毒T细胞反应的消失有关,这可能是恒河猴A01死亡的原因。
在长期无病毒的两只恒河猴中,我们在327周后进一步分析了它们的抗原特异性T细胞反应。相比A04,A02显示出更高频率的Gag-p27和Nef特异性T细胞反应,而健康的未接种疫苗/未感染的恒河猴几乎没有SHIV特异性T细胞反应。特别地,Nef抗原并不包含在pRhPD1-p27疫苗中,所以A02和A04中针对Nef的T细胞反应表明了对SHIVSF162P3CN感染的新生免疫响应。
为了深入了解恒河猴A02和A04中T细胞的免疫响应,我们专门研究了这些T细胞在应对Gag-p27抗原时的多重功能性,这包括它们能够产生的几种关键免疫因子:干扰素-γ(IFN-γ)、肿瘤坏死因子-α(TNF-α)和白细胞介素-2(IL-2)。
通过一种叫做内细胞因子染色(ICS)的技术,我们观察到,大部分针对Gag-p27的CD8+ 和CD4+ T细胞都能同时释放IFN-γ和TNF-α,显示出它们具有双重功能(图2C-F)。我们还对这些T细胞的记忆类型进行了分析,发现绝大多数能产生IFN-γ的CD8+ 或CD4+ T细胞在接触Gag-p27抗原后,仍旧保持着效应记忆T细胞的特性,即它们在表面标记物CD95、CCR7和CD28的表达上显示出特定的模式(图2G-I)。
总的来说,这些观察结果说明,这两只幸存的恒河猴体内一直保持着长期存在的、具有多种功能的、针对特定抗原的效应记忆T细胞。
接种了pRhPD1-p27疫苗的恒河猴在控制病毒血症和维持长期的T细胞免疫反应方面展现出了明显的优势
由于对照组中未接种疫苗且感染了病毒的恒河猴均未能存活,我们将这两只恒河猴与另外两只在感染后立即接受了一种名为BiIA-SG的双特异性中和抗体治疗的SHIV感染控制者恒河猴(C05和C06)进行了对比。
C05和C06在经历了同样剂量的SHIVSF162P3CN挑战后,能够存活超过284周的时间。在最近的检测中,A02、A04、C05和C06的血浆中病毒量均未被检测到。在前病毒负荷方面,A02显示出了最低水平,每1×10^6 个PBMCs中仅有0.05个病毒拷贝,而其他三只恒河猴的前病毒负荷则在每1×10^6 PBMCs中保持在0.25到0.81个病毒拷贝的范围内。
最后的检测点显示,与接受了BiIA-SG治疗的两只恒河猴相比,接种了pRhPD1-p27疫苗的两只恒河猴在CD4+ T细胞的频率和CD4+/CD8+ T细胞比率上展现了更好的趋势。总的来说,pRhPD1-p27疫苗不仅在病毒控制方面与采用先进的广谱中和抗体治疗相媲美,甚至在某些方面表现得更好。
接下来,我们比较了这些恒河猴对抗病毒抗原的T细胞反应。A02和A04在针对p27抗原的功能性CD4+ 和CD8+ 效应记忆T细胞反应方面,表现出了比C05和C06更高的活跃度(图3E和F)。特别值得一提的是,A02中既针对Gag-p27也针对Nef的多功能CD4+ 和CD8+ T细胞的比例是最高的。A02中针对Nef的功能性效应记忆T细胞反应与针对Gag-p27的反应水平相似(图3E和F)。
同样,在CD4+ 和CD8+ T细胞的分组中,A02和A04展现的针对Gag-p27的效应记忆T细胞(CD95高CCR7低CD28高/低)的比例也超过了C05和C06(图3G和H)。因此,与BiIA-SG治疗相比,pRhPD1-p27疫苗接种在长期的T细胞反应上显示出更好的趋势,这对于抑制病毒非常重要。
研究发现,与HIV-1病毒有效抵抗相关的,是T细胞对病毒Gag蛋白的广泛识别能力。我们此前的研究已经证明,通过pRhPD1-p27疫苗激活的T细胞能够针对恒河猴体内病毒Gag-p27蛋白的多个部位发起攻击。本次,我们通过更精细的技术手段,针对整个SIV Gag-p27蛋白,使用一系列重叠的15个氨基酸长的肽段,来确定接种疫苗六年后的恒河猴A02和A04体内是否存在与早期疫苗接种阶段相匹配的T细胞识别区域。
通过综合使用ELISpot和ICS技术,我们在这两只恒河猴中各自识别出了三个核心T细胞识别区域,数量相较于接种疫苗阶段有所减少。值得注意的是,我们在这两只恒河猴中均找到了与之前相匹配的T细胞识别区域(A02有一个CD4+ T细胞的识别区域;A04有一个CD4+和两个CD8+ T细胞的识别区域)。这一结果进一步证实了,基于PD-1的DNA疫苗能够长期激发恒河猴体内的T细胞反应,即使在病毒挑战六年后,这种免疫反应仍然活跃。

图2 在接受了pRhPD1-p27疫苗接种并面对SHIV挑战的恒河猴身上,我们观察到了持久的p27特异性效应记忆T细胞活动。这些活动是通过对A组恒河猴的外周血单个核细胞(PBMCs)在122周和327周后进行特定的实验刺激后测量得出的,这些实验包括IFN-γ ELISpot实验和流式细胞术的内细胞因子染色技术。具体来说,在122周后,我们检测到所有四只A组恒河猴的T细胞反应。在327周后,我们不仅在A组的两只恒河猴(A02和A04)中,还在12只未接种疫苗且未感染的健康恒河猴中进行了类似的T细胞反应测量。通过实验,我们能够看到CD4+和CD8+T细胞在接受刺激后产生了哪些细胞因子,无论是仅使用培养基还是p27肽池进行刺激。此外,我们还测量了这些T细胞产生IFN-γ、TNF-α和IL-2这三种细胞因子的频率,以及这些p27特异性T细胞的表面特性。最后,我们对比了总体T细胞群体和产生IFN-γ的p27特异性T细胞中,效应记忆T细胞的比例,这包括CD4+和CD8+T细胞两个子群体。这些研究结果表明,即使在经历了长时间的病毒挑战后,通过pRhPD1-p27疫苗接种激发的T细胞反应仍然保持活跃。
结果讨论
在我们的进一步研究中,我们证实了一种名为pRhPD1-p27的基于PD-1的DNA疫苗能够在恒河猴体内实现长期的病毒控制,使它们在面临一种特定的SHIVSF162P3CN病毒挑战后能够存活超过六年。这种无病毒状态的持续时间与之前一项名为“迈阿密猴”的研究结果相似,那项研究中的猴子在接受挑战后接收了一种能够表达几种强效中和抗体的治疗。
不同于需要持续中和抗体存在才能控制病毒的治疗方式,我们的这种基于PD-1的DNA疫苗通过激活强大的多功能效应记忆型抗原特异性T细胞反应,实现了不依赖于传统抗逆转录病毒治疗或中和抗体治疗的病毒学控制。我们的研究还指出,CD8+ T细胞在控制病毒复制中发挥了关键作用,这一发现得到了我们之前一项关于体内CD8+ T细胞消耗的研究的支持。
即便在接种疫苗六年后,A02和A04这两只恒河猴体内特定抗原的T细胞依旧保持着长期的活性。更重要的是,这些猴子体内在接种疫苗阶段识别出的T细胞表位在经历了SHIV挑战后仍旧保持了免疫活性。
与接受了一种名为BiIA-SG的双特异性中和抗体治疗并因此没有病毒出现在血液中的两只恒河猴C05和C06相比,A02和A04这两只恒河猴在抗击病毒的T细胞免疫力方面呈现出更强的趋势。特别是,在接受Gag-p27刺激后,A02和A04中超过70%的CD8+ T细胞展现了多功能性,能够产生至少两种细胞因子,而C05和C06中的CD8+ T细胞分别只有0%和60%能做到这一点。
这说明了A02和A04中T细胞的功能性似乎更强。此外,基于PD-1的DNA疫苗对抗SHIV挑战的益处还体现在SHIV感染后新产生并长期维持抗Nef T细胞反应上,这证明了这些接种了疫苗的恒河猴在经历病毒挑战后,其T细胞的反应能力得到了保留。
虽然A02和A04这两只恒河猴都没有出现病毒血症,但它们体内的抗病毒T细胞反应却有所不同。比如,A02对p27和Nef的T细胞反应都比A04更强。这可能是因为A02中特定抗原的T细胞反应保持在较高水平,是由潜在感染细胞中病毒抗原的自发性表达触发的。
不过,A02的白细胞中的前病毒量在所有检测的五只恒河猴中最低,这意味着维持高水平的病毒特异性T细胞反应可能并不依赖于前病毒水平。虽然因为样本量小而难以确定前病毒负荷与T细胞反应强度之间的具体关系,但A02中持续的高水平T细胞反应或许有助于清除潜伏感染的细胞,从而减小病毒库的规模。
最近,一项利用腺病毒载体传递经过电脑设计的复合病毒抗原的HIV预防疫苗的后期临床试验因为未能有效预防HIV感染而停止了。研究人员一直在努力开发新的预防性HIV疫苗,旨在激发针对HIV-1不同亚型的广泛中和抗体反应。
与此同时,为了消灭被病毒感染并产生病毒抗原的细胞,开发能够持久激活T细胞反应的策略成为了治疗性HIV疫苗研究的主要方向。近期关于HIVACAT T细胞免疫原(HTI)疫苗方案的一期临床试验显示,通过疫苗激发的针对特定抗原的T细胞反应能显著延长患者在中断抗逆转录病毒治疗期间不需要cART治疗的时间,并且在中断治疗结束时达到更低的病毒量。
这一发现支持了基于PD1的治疗性T细胞疫苗在实现HIV-1患者无需持续抗逆转录病毒治疗的病毒控制方面的临床开发。
这项研究的一个局限性在于,接受了PD-1增强型DNA疫苗的恒河猴数量相对较少。尽管如此,通过对这些恒河猴的长期跟进研究,我们发现使用基于PD-1的DNA疫苗有望激发针对特定病毒的T细胞反应,从而实现不依赖于常规抗逆转录病毒治疗的艾滋病毒控制。
在A组接受pRhPD1-p27疫苗接种并面临SHIV挑战的四只恒河猴中,A02和A04两只猴子仍然存活,且未检测到病毒载量。与此相反,A01和A03两只猴子不得不被安乐死。A01在挑战后存活到了146周,但从挑战后的第125周开始,它的血浆病毒载量开始逐渐上升,在被安乐死时血浆中的病毒RNA拷贝数约为5×10^3/mL。第二只猴子A03在挑战后的第194周因健康状况急剧恶化而被安乐死。
由于此事件发生在COVID-19大流行期间的封锁时期,未能进行病毒载量检测或尸检。在安乐死前5周的感染后第189周,A03的状况仍然没有病毒血症,因此A03的死亡可能与SHIV感染无关。我们注意到A组和B组之间存活率有所不同。两组疫苗接种方案的不同可能影响了长期的临床结果。此外,A组中的动物在挑战后约2年接受了CD8+ T细胞的耗尽治疗,并重新接种了pRhPD1-p27疫苗。
CD8耗尽过程影响了短期的病毒学和免疫学状况,但这并不会对A组观察到的病毒清除产生积极影响。相比之下,挑战后2年的加强接种提高了抗Gag-p27记忆CD8+ T细胞的反应。这种加强接种旨在评估在慢性阶段接种疫苗的效果,并可能原则上延长恒河猴的无病毒状态。这一发现有助于指导未来治疗性疫苗接种的剂量策略设计。
值得一提的是,A02和A04携带了一种可能具有保护作用的MHC-I基因,名为Mamu-B017。无论是否接种疫苗,携带Mamu-B017基因的恒河猴在慢性病毒载量上都显示出了10到20倍的显著下降。但是,大部分携带Mamu-B17基因的恒河猴在慢性SIV感染期间仍然存在病毒血症,血浆中病毒RNA拷贝数超过200/mL。
在慢性感染阶段,只有大约10%的恒河猴血浆中的病毒载量低于200拷贝/mL。还有一项研究对Mamu-B017+恒河猴进行了疫苗接种效果评估,结果发现仅有一只未接种疫苗的Mamu-B017+恒河猴自然控制了SIV感染。对这些恒河猴接种含有vif、rev、tat和nef抗原的疫苗,虽然激发了特定抗原的CD8+T细胞,但这并没有带来长期的病毒控制效果。这与我们的研究结果不同,我们的研究证明了通过基于PD-1的DNA疫苗引发的CD8+T细胞在控制病毒复制中的关键作用。
此外,目前还没有在SIV Gag抗原上发现能被Mamu-B017限制的T细胞所识别的抗原表位。鉴于我们的疫苗是以Gag-p27作为抗原,这意味着Mamu-B*017的存在并不是我们模型中观察到的长期病毒抑制和生存期延长的决定因素。尤其值得注意的是,与A03相似,B组的三只恒河猴(B01-B03)也没有因病毒反弹而死亡,这进一步证实了基于PD-1的DNA疫苗在实现长期不依赖cART治疗的病毒控制方面的有效性。
为了使这种疫苗能够应用于人类,研究者们开发了一种新型的基于PD-1的DNA疫苗,这种疫苗包含了一种与PD-1相连的、能够针对HIV-1 Gag抗原的双价镶嵌设计,被称为ICVAX。通过将PD-1基础的DNA疫苗技术与镶嵌抗原设计策略相结合,预先在恒河猴上的研究已经展示了这种疫苗能够激发出强大的、广泛反应的、多功能的Gag抗原T细胞反应。ICVAX疫苗目前正在进行第一阶段的临床试验,这项试验旨在评估这一新型治疗疫苗平台在HIV患者中的安全性和免疫性(已在中国临床试验注册,注册号为CTR20223007)。
总的来说,这项研究为我们提供了更多的证据,表明通过基于PD-1的DNA疫苗接种策略,在开发治疗性艾滋病疫苗方面具有巨大的潜力。它通过激发持久的针对病毒的特异性T细胞反应,有望实现一个无需持续使用抗逆转录病毒治疗的病毒控制状态。
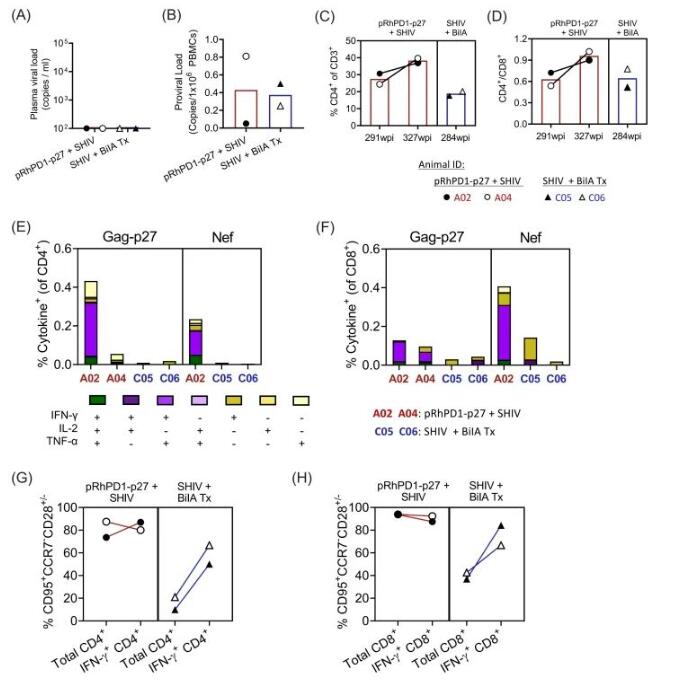
图3 在经历了SHIV挑战的两组恒河猴中,一组是接种了pRhPD1-p27疫苗的,另一组是在SHIV挑战后一天接受了一种名为BiIA的双特异性中和抗体治疗的,我们进行了一项病毒学和细胞免疫学上的对比研究。具体来说,我们比较了接种了pRhPD1-p27疫苗的恒河猴A02和A04在挑战319周后的血浆中病毒量和它们白细胞中的前病毒量,以及两只在SHIV挑战后一天就接受BiIA治疗的恒河猴C05和C06在挑战269周后的情况。我们还测量了这些恒河猴在不同时间点的CD4+细胞占CD3+ T细胞的百分比和CD4+/CD8+ T细胞比率。此外,我们还对这两组恒河猴中诱导的Gag-p27特异性CD4+和CD8+T细胞的多功能性进行了分析,使用的是流式细胞术的内细胞因子染色技术。我们还研究了这些恒河猴体内被激活的Gag-p27特异性CD4+和CD8+T细胞的表型。
材料与方法
动物和研究设计
实验使用了来自中国的雌性恒河猴,这些猴子在佛山大学的动物研究中心饲养,且在实验开始前没有被感染猿免疫缺陷病毒。
研究涉及的恒河猴包括接种了PD-1基因增强的pRhPD1-p27 DNA疫苗并后续挑战了SHIVSF162P3CN病毒的A01–A04和B01-B03组,这部分在之前的研究(由Wong等人发表)中有报道。
另外,有七只作为对照组的恒河猴也接受了SHIVSF162P3CN病毒的挑战,同样在之前的研究中被提及。此外,还有两只恒河猴C05和C06,在接受SHIVSF162P3CN病毒挑战的第一天,接受了一种双特异性中和抗体BiIA的治疗,这部分在另一项研究(发表于文献16)中有描述。
关于病毒定量的测定方法
研究中通过特定的技术从血浆中提取病毒RNA,并将其转录为cDNA,然后利用实时定量PCR技术测定血浆中的病毒RNA拷贝数。此外,为了测定与细胞相关的DNA病毒载量,研究中首先从PBMC中提取DNA,再使用实时定量PCR技术进行测定,结果会根据白蛋白基因的拷贝数进行标准化,以确保测量结果的准确性。
细胞免疫检测
在这项研究中,我们采用了Ficoll密度梯度离心法从恒河猴体内分离外周血单个核细胞(PBMCs),进而利用这些细胞在IFN-γ ELISpot或细胞内细胞因子染色实验中评估T细胞免疫反应,这与我们之前的研究方法一致。在ELISpot实验中,每次实验使用2×10^5个PBMCs,并用含有SIVmac239 Gag-p27和Nef抗原的15肽重叠肽池进行刺激,以激发T细胞反应,并通过专门的试剂盒测定这些反应。
未添加肽段的PBMCs用于确定实验的背景水平。在细胞内细胞因子染色实验中,我们用同样浓度的肽池刺激多达1×10^6个PBMCs,并添加特定的抗体以促进反应。孵育一段时间后,我们对细胞进行了一系列的染色处理,以便在流式细胞仪上检测不同的细胞因子。此外,我们还使用了一系列特定的抗体来标记不同的细胞类型和细胞因子,并采用特殊染料区分活细胞和死细胞。
收集的数据通过专业软件进行分析。在评估个别肽段对T细胞反应的影响时,我们先用ELISpot实验筛选出能显著激发IFN-γ反应的肽段,然后再通过细胞内细胞因子染色实验进一步验证这些反应。最后,我们还通过流式细胞分析确定了CD4+ T细胞在所有CD3+ T细胞中的比例以及CD4+/CD8+ T细胞比率,以全面评估T细胞免疫反应。
统计分析
我们采用了Prism v8(GraphPad)这款软件来对数据进行统计分析。为了评估生存率的差异,我们使用了对数秩检验方法。只有当概率值(P值)小于0.05时,我们才认为结果在统计学上是有显著意义的。
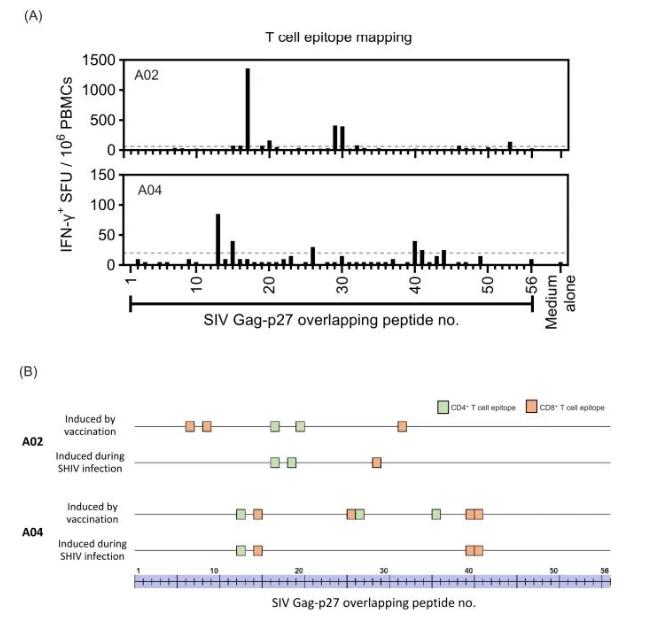
图4 在接种了pRhPD1-p27疫苗并感染了SHIV的两只恒河猴A02和A04中,我们进行了针对Gag-p27抗原的T细胞识别区域的详细分析。这项分析通过使用一系列相互重叠的15个氨基酸长的肽段来刺激这些猴子的外周血单个核细胞(PBMCs),这些肽段完整覆盖了Gag-p27抗原。我们首先在IFN-γ ELISpot实验中确认了能够引发反应的肽段,然后进一步通过内细胞因子染色(ICS)实验来测试这些肽段刺激T细胞产生IFN-γ的能力。(A)部分展示了IFN-γ ELISpot实验的数据,而(B)部分则提供了两只恒河猴在接种疫苗阶段和SHIV挑战后327周时,CD4+和CD8+ T细胞识别的特定区域的对比分析,这里使用了绿色和橙色框来分别标记CD4+和CD8+ T细胞识别的区域。
注释:
PD-1: 指的是“程序性死亡-1”(Programmed Death-1),是一种免疫检查点蛋白,与免疫系统调节相关。在这里,它是用来指代基于PD-1的疫苗策略。
pRhPD1-p27: 是特定的疫苗名称,其中“pRh”可能指的是疫苗载体或构建方式,"PD1"指的是程序性死亡-1,而“p27”是HIV病毒中一个特定的蛋白或抗原部分。
SHIV: 指的是猿-人类免疫缺陷病毒(Simian/Human Immunodeficiency Virus),是一种结合了HIV(人类免疫缺陷病毒)和SIV(猿免疫缺陷病毒)特性的实验室制造病毒,用于研究HIV的疫苗和治疗方法。
SIV: 指的是猿免疫缺陷病毒(Simian Immunodeficiency Virus),是一种影响非人灵长类动物的病毒,与人类的HIV相似。
Mamu-B*017: 是一种特定的MHC-I(主要组织相容性复合体I类)基因等位基因的名称,与恒河猴的免疫反应特性相关。
AAVs: 指的是腺相关病毒(Adeno-associated viruses),是一类常用于基因治疗和疫苗载体的病毒。
MHC-I: 主要组织相容性复合体I类(Major Histocompatibility Complex class I),是细胞表面的蛋白质,与免疫系统的抗原呈递功能相关。
信息来源:ASM Journals Microbiology Spectrum Vol. 11, No. 6 A follow-up study: 6-year cART-free virologic control of rhesus macaques after PD-1-based DNA vaccination against pathogenic SHIVSF162P3CN challenge DOI: https://doi.org/10.1128/spectrum.03350-23
编译:松鼠哥
【责任编辑:阿杰 邮箱:xjpop@vip.qq.com】



