CCO | 暴露后预防(PEP)在艾滋病预防中的应用指南
发布日期:2021-04-01
点击:次
 |


一、PEP的历史
暴露后预防(Post-exposure prophylaxis, PEP)早在十九世纪90年代就开始用于职业暴露处理。美国疾病预防控制中心(USCDC)和世界卫生组织(WHO)分别在2005年和2007年发布了PEP指南。
本文针对WHO、美国和欧洲关于PEP的最新指南,以及中国艾滋病治疗指南中关于PEP的内容进行了梳理和总结,讨论PEP应用于艾滋病预防的相关场景和标准。本文涉及的指南文本包括:
-
2016, WHO, “Consolidated Guidelines on the Use of Antiretroviral Drugs for Treating and Preventing HIV Infection”
-
2016, USCDC, “Updated Guidelines for Antiretroviral Postexposure Prophylaxis After Sexual, Injection Drug Use, or Other Nonoccupational Exposure to HIV—United States, 2016”
-
2018,中华医学会感染病学分会艾滋病丙型肝炎学组、中国疾病预防控制中心,《中国艾滋病诊疗指南(2018版)》
-
2020, New York State Department of Health AIDS Institute, “PEP to Prevention HIV”
-
2020, European AIDS Clinical Society (EACS), “Guidelines (version 10.1)”
如果出现下列两种情况之一,则不适用PEP:
1)自己已经感染HIV;
2)对方明确是HIV阴性。
如果以上两点均不满足,或无法确定,则需要从两方面的考虑此次暴露的风险性:
一是暴露接触的体液类型。
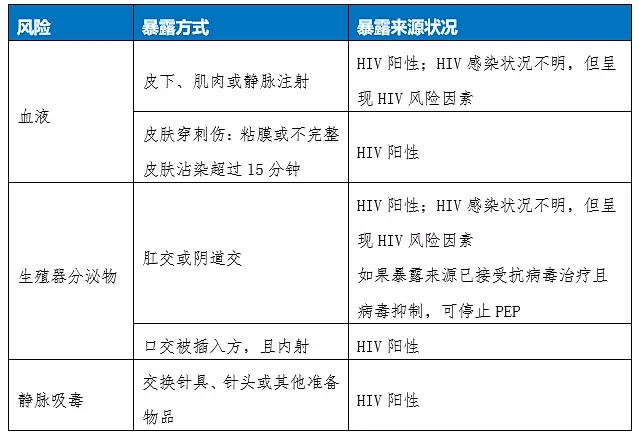
WHO(2016)指南中罗列了可能造成艾滋病传播的体液,主要包括血液、带血的唾液、乳汁、生殖器分泌物,以及脑脊液、关节液、心包积液、羊水、腹水、胸水等。中国指南(2018)则认为脑脊液、关节液、心包积液、羊水、腹水、胸水具有传染性,但其引起感染的危险程度尚不明确。
二是暴露的方式。
风险较高的暴露方式主要包括:1)粘膜(例如性接触,溅到眼睛、鼻子或口腔等)和 2)注射或穿刺(例如输血、针刺等)。
EACS(2020)指南中详细说明可能造成HIV感染的暴露方式,其中值得注意的是在“皮肤穿刺伤”部分,明确说明是“粘膜或不完整皮肤沾染(体液)超过15分钟”才需要考虑暴露后预防。
附表1:EACS(2020)指南暴露后预防场景
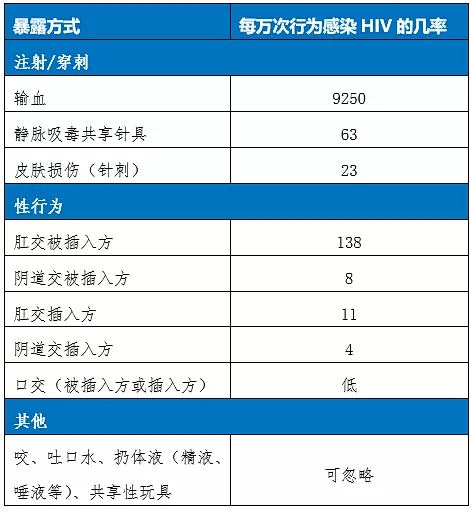
 USCDC则明确列出了单次行为感染HIV的风险,有助于具体评估被暴露者的感染风险,从而决定是否推荐使用PEP。
附表2:USCDC(2016)单次行为感染HIV风险一览表
USCDC则明确列出了单次行为感染HIV的风险,有助于具体评估被暴露者的感染风险,从而决定是否推荐使用PEP。
附表2:USCDC(2016)单次行为感染HIV风险一览表
 中国指南(2018)指出:如暴露源为HIV感染者的血液,那么经皮肤损伤暴露感染HIV的危险性为0.3%,经黏膜暴露为0.09%,经不完整皮肤暴露的危险度尚不明确,一般认为比黏膜暴露低。
PEP治疗方案目前都是推荐使用三种药物联合使用,其中骨干药物较为明确,一般推荐替诺福韦(TDF)+拉米夫定(3TC)或恩曲他滨(FTC),包括TDF/FTC或TDF/3TC合剂。EACS(2020)的指南增加了丙酚替诺福韦(TAF),但纽约卫生局(2020)则没有纳入TAF,主要因为研究发现TAF在“阴道、宫颈、直肠中的药物浓度(较TDF)更低”。USCDC和中国CDC针对肾功能受损者,推荐齐多夫定(AZT)+拉米夫定(3TC),但纽约卫生局(2020)已经明确不再推荐AZT用于PEP。
第三种药物的选择则体现出了较大的多样性:
WHO(2016)首推的是洛匹那韦/利托那韦(LPV/r)或阿扎那韦(ATV);替代方案为拉替拉韦(RAL)、达卢那韦/利托那韦(DRV/r)或依非韦仑(EFV)。其中依非韦仑因为可能导致早期的神经精神倒错,不建议有焦虑情绪的人使用。
USCDC(2016)和纽约卫生局(2020)首推拉替拉韦(RAL)或多替拉韦(DTG);替代方案为达卢那韦/利托那韦(DRV/r)。纽约卫生局(2020)的替代方案还包括阿扎那韦(ATV)或福沙那韦/利托那韦(FPV/r)。
EACS(2020)首推拉替拉韦(RAL)或达卢那韦/利托那韦(DRV/r);替代方案包括多替拉韦(DTG)或必妥维(TAF/FTC/BIC)合剂。
中国指南(2018)首推拉替拉韦(RAL)或其他INSTIs;替代方案为洛匹那韦/利托那韦(LPV/r)或达卢那韦/利托那韦(DRV/r)。
合剂方面,EACS(2020)推荐必妥维(TAF/FTC/BIC)三合一合剂作为备选方案;纽约卫生局(2020)推荐Stribild(EVG/COBI/FTC/TDF)四合一合剂备选。
另外,其他创新药物在PEP应用中具有广泛前景,例如已经批准上市的艾博韦泰(ABT)是一种长效HIV融合抑制剂,作用于病毒进入细胞的初始环节,阻断病毒进入细胞,用药后72秒迅速达到血药峰值,半衰期长达12天,安全性好,具有暴露后预防用药的优势。
1、使用前的检查和评估:
USCDC(2016)在这方面的规定最为详尽,所有人都需要做HIV、乙肝(表面抗体、表面抗原、核心抗体)和丙肝检测;对经性暴露的人,还需要做性病检测(包括梅毒、淋病、衣原体)和孕检;对采用TDF/FTC+RAL或DTG方案的人,还需要额外做肌酐和转氨酶检测。EACS(2020)只规定做HIV、乙肝、丙肝和孕检,但要求在暴露后48小时内。
WHO(2016)专门提及了对于乙肝病毒携带者,需严格监控PEP停止后是否发生乙肝病毒爆发。USCDC(2016)将范围明确限定在活跃的乙肝病毒携带者(即乙肝表面抗原[HBsAg]阳性)。
2、咨询和随访:
USCDC(2016)要求在48小时内进行回访,了解是否获得PEP药物,评估药物耐受度和服药依从性;并在第2周再进行一次回访,确保药物获得并了解服药副作用。WHO(2016)也建议为PEP使用者提供依从性强化咨询。
EACS(2020)建议PEP结束时及结束一个月各做1次HIV检测。中国指南(2018)则建议发生HIV职业暴露后立即、4周、8周、12周和6个月后各检测1次HIV 抗体。
中国指南(2018)指出:如暴露源为HIV感染者的血液,那么经皮肤损伤暴露感染HIV的危险性为0.3%,经黏膜暴露为0.09%,经不完整皮肤暴露的危险度尚不明确,一般认为比黏膜暴露低。
PEP治疗方案目前都是推荐使用三种药物联合使用,其中骨干药物较为明确,一般推荐替诺福韦(TDF)+拉米夫定(3TC)或恩曲他滨(FTC),包括TDF/FTC或TDF/3TC合剂。EACS(2020)的指南增加了丙酚替诺福韦(TAF),但纽约卫生局(2020)则没有纳入TAF,主要因为研究发现TAF在“阴道、宫颈、直肠中的药物浓度(较TDF)更低”。USCDC和中国CDC针对肾功能受损者,推荐齐多夫定(AZT)+拉米夫定(3TC),但纽约卫生局(2020)已经明确不再推荐AZT用于PEP。
第三种药物的选择则体现出了较大的多样性:
WHO(2016)首推的是洛匹那韦/利托那韦(LPV/r)或阿扎那韦(ATV);替代方案为拉替拉韦(RAL)、达卢那韦/利托那韦(DRV/r)或依非韦仑(EFV)。其中依非韦仑因为可能导致早期的神经精神倒错,不建议有焦虑情绪的人使用。
USCDC(2016)和纽约卫生局(2020)首推拉替拉韦(RAL)或多替拉韦(DTG);替代方案为达卢那韦/利托那韦(DRV/r)。纽约卫生局(2020)的替代方案还包括阿扎那韦(ATV)或福沙那韦/利托那韦(FPV/r)。
EACS(2020)首推拉替拉韦(RAL)或达卢那韦/利托那韦(DRV/r);替代方案包括多替拉韦(DTG)或必妥维(TAF/FTC/BIC)合剂。
中国指南(2018)首推拉替拉韦(RAL)或其他INSTIs;替代方案为洛匹那韦/利托那韦(LPV/r)或达卢那韦/利托那韦(DRV/r)。
合剂方面,EACS(2020)推荐必妥维(TAF/FTC/BIC)三合一合剂作为备选方案;纽约卫生局(2020)推荐Stribild(EVG/COBI/FTC/TDF)四合一合剂备选。
另外,其他创新药物在PEP应用中具有广泛前景,例如已经批准上市的艾博韦泰(ABT)是一种长效HIV融合抑制剂,作用于病毒进入细胞的初始环节,阻断病毒进入细胞,用药后72秒迅速达到血药峰值,半衰期长达12天,安全性好,具有暴露后预防用药的优势。
1、使用前的检查和评估:
USCDC(2016)在这方面的规定最为详尽,所有人都需要做HIV、乙肝(表面抗体、表面抗原、核心抗体)和丙肝检测;对经性暴露的人,还需要做性病检测(包括梅毒、淋病、衣原体)和孕检;对采用TDF/FTC+RAL或DTG方案的人,还需要额外做肌酐和转氨酶检测。EACS(2020)只规定做HIV、乙肝、丙肝和孕检,但要求在暴露后48小时内。
WHO(2016)专门提及了对于乙肝病毒携带者,需严格监控PEP停止后是否发生乙肝病毒爆发。USCDC(2016)将范围明确限定在活跃的乙肝病毒携带者(即乙肝表面抗原[HBsAg]阳性)。
2、咨询和随访:
USCDC(2016)要求在48小时内进行回访,了解是否获得PEP药物,评估药物耐受度和服药依从性;并在第2周再进行一次回访,确保药物获得并了解服药副作用。WHO(2016)也建议为PEP使用者提供依从性强化咨询。
EACS(2020)建议PEP结束时及结束一个月各做1次HIV检测。中国指南(2018)则建议发生HIV职业暴露后立即、4周、8周、12周和6个月后各检测1次HIV 抗体。
信息发布:【高翔】
项目支持:【新疆】
联系方式:13999198395 QQ\微信:137655 公益转编,侵删
新疆乌鲁木齐艾滋病检测、艾滋病阻断、HIV检测、HIV阻断、公益组织、感染者咨询 电话13999198395
| 姓名 |
电话 |
| HIV药物阻断 |
|
| HIV药物预防 |
| 采血结果查询 |
|
| HIV检测 |
|
| A友健康互助群 |
|
 |
 |
 |
|








