HIV暴露前预防药物安全吗?你关心的七个安全性问题
发布日期:2021-12-24
点击:次
 |


内容摘要
1.HIV暴露前预防(PrEP)在HIV暴露高风险人群中可降低至少90%的感染风险,值得推广;
2. TDF/FTC是我国唯一获批HIV PrEP适应证的药物,也是WHO首个推荐用于HIV PrEP的口服药物,已在全球>50个国家和地区获批使用;
3. TDF/FTC整体安全性良好,对肾功能、骨密度影响小,不影响性功能,可在妊娠期使用,与PDE-5抑制剂、避孕药等无明显药物相互作用;
4. 采用TDF/FTC进行PrEP前必须进行检测,确保用药者没有感染HIV。
专家简历
 暴露前预防(pre-exposure prophylaxis, PrEP)是HIV综合预防策略中重要的预防方法之一,未感染者服用HIV治疗药物,在体内达到具保护性的药物浓度,以降低其接触病毒后的感染风险。
PrEP适用于未感染HIV的HIV感染者的配偶、与HIV高风险男性发生性行为的男性和跨性别女性,以及注射毒品人群等[1,2]。
目前富马酸替诺福韦二吡呋酯/恩曲他滨(TDF/FTC)是我国唯一获批HIV PrEP适应证的药物,也是WHO首个推荐用于HIV PrEP的口服药物,已在全球>50个国家和地区获批使用[3]。
应用十余年来,大量证据显示,PrEP在HIV暴露高风险人群中可降低至少90%的感染风险,美国、肯尼亚、乌干达等多个国家的横断面流行病学调查也都反映出PrEP推广后HIV新发感染病例数显著下降。
注意:实施PrEP前必须进行HIV检测,确保用药者没有感染HIV。
对已经感染但从未被诊断出的HIV阳性者进行PrEP可能会导致耐药发生,对其后续治疗产生严重的不良后果。
此外,基线实验室检查还需排除服用TDF/FTC的禁忌证和相关情况。
安全性是影响高风险人群PrEP的意愿和用药依从性的主要因素之一。TDF/FTC作为PrEP药物安全性如何?本文将为您解答。
TDF/FTC用于PrEP的整体安全性良好
TDF/FTC作为PrEP用药具有良好的安全性和耐受性。在PrEP刚开始的4周内,有少部分个体服药后可能会出现轻度的恶心、头痛、体重减轻或其他症状,但大多数症状在之后4周内会消失或缓解[1]。
应对:PrEP药物的不良反应并不常见,通常会在服用药物后的第一个月内得到缓解,医生或公共卫生人员可以推荐PrEP参与者使用非处方药来治疗头痛、恶心和肠胃气胀等症状[1]。
TDF/FTC用于PrEP对肾功能影响较小
总体来看,TDF用药后可致一过性的轻度肌酐清除率下降,停药后可恢复。
iPrEx研究的结果显示,PrEP组参与者的肌酐清除率(CrCl)有小幅的下降,这种下降从第4周开始出现,持续到停药,在停药后逐渐逆转。研究人员没有发现这种变化有种族、年龄和高血压病史的差异,不过会受到非甾体抗炎药物使用的影响[4]。
暴露前预防(pre-exposure prophylaxis, PrEP)是HIV综合预防策略中重要的预防方法之一,未感染者服用HIV治疗药物,在体内达到具保护性的药物浓度,以降低其接触病毒后的感染风险。
PrEP适用于未感染HIV的HIV感染者的配偶、与HIV高风险男性发生性行为的男性和跨性别女性,以及注射毒品人群等[1,2]。
目前富马酸替诺福韦二吡呋酯/恩曲他滨(TDF/FTC)是我国唯一获批HIV PrEP适应证的药物,也是WHO首个推荐用于HIV PrEP的口服药物,已在全球>50个国家和地区获批使用[3]。
应用十余年来,大量证据显示,PrEP在HIV暴露高风险人群中可降低至少90%的感染风险,美国、肯尼亚、乌干达等多个国家的横断面流行病学调查也都反映出PrEP推广后HIV新发感染病例数显著下降。
注意:实施PrEP前必须进行HIV检测,确保用药者没有感染HIV。
对已经感染但从未被诊断出的HIV阳性者进行PrEP可能会导致耐药发生,对其后续治疗产生严重的不良后果。
此外,基线实验室检查还需排除服用TDF/FTC的禁忌证和相关情况。
安全性是影响高风险人群PrEP的意愿和用药依从性的主要因素之一。TDF/FTC作为PrEP药物安全性如何?本文将为您解答。
TDF/FTC用于PrEP的整体安全性良好
TDF/FTC作为PrEP用药具有良好的安全性和耐受性。在PrEP刚开始的4周内,有少部分个体服药后可能会出现轻度的恶心、头痛、体重减轻或其他症状,但大多数症状在之后4周内会消失或缓解[1]。
应对:PrEP药物的不良反应并不常见,通常会在服用药物后的第一个月内得到缓解,医生或公共卫生人员可以推荐PrEP参与者使用非处方药来治疗头痛、恶心和肠胃气胀等症状[1]。
TDF/FTC用于PrEP对肾功能影响较小
总体来看,TDF用药后可致一过性的轻度肌酐清除率下降,停药后可恢复。
iPrEx研究的结果显示,PrEP组参与者的肌酐清除率(CrCl)有小幅的下降,这种下降从第4周开始出现,持续到停药,在停药后逐渐逆转。研究人员没有发现这种变化有种族、年龄和高血压病史的差异,不过会受到非甾体抗炎药物使用的影响[4]。
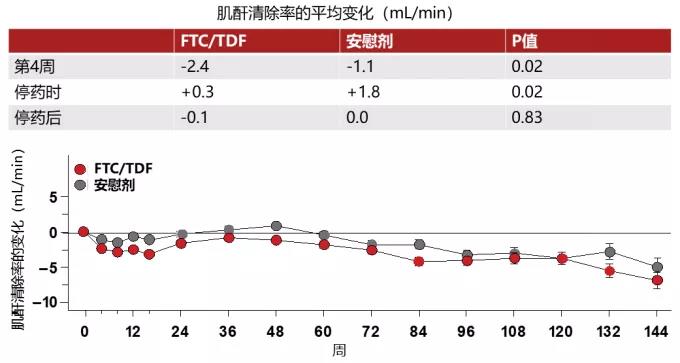 iPrEx研究PrEP组参与者的肌酐清除率(CrCl)变化
估计肾小球滤过率(eGFR)的变化与CrCl类似,Partners PrEP研究[5]和ANRS-IPERGAY试验数据分析[6]的结果均显示,TDF/FTC用于PrEP肾脏安全性良好,PrEP期间eGFR有小幅的变化,且能够在停药后恢复。
iPrEx研究PrEP组参与者的肌酐清除率(CrCl)变化
估计肾小球滤过率(eGFR)的变化与CrCl类似,Partners PrEP研究[5]和ANRS-IPERGAY试验数据分析[6]的结果均显示,TDF/FTC用于PrEP肾脏安全性良好,PrEP期间eGFR有小幅的变化,且能够在停药后恢复。
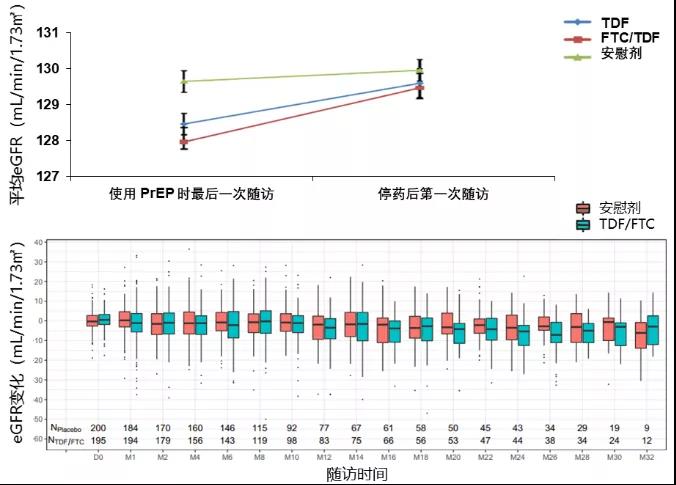 Partners PrEP研究(上)和ANRS-IPERGAY试验(下)中,eGFR的变化趋势
在HIV/AIDS干预青少年药物试验网络(ATN)队列110(18-22岁)和113(15-17岁)中,只有ANT 110中的一例报告了肌酐水平的一级升高,且在后续的随访中恢复了正常[7]。
应对:在HIV感染的治疗指南中,对估计肌酐清除率(eCrCl)<60 mL/min的受试者不建议使用TDF或TDF/FTC,并且PrEP使用者需要每6个月至少检测一次肾功能,如果出现肾功能异常,需仔细检查肾功能异常的原因。如果怀疑是由TDF引起的,应考虑停药。对于急性肾损伤等需要紧急评估的症状,应咨询专业医务人员[7]。
TDF/FTC用于PrEP对骨密度影响较小
总体来看,服用TDF/FTC的受试者骨密度略有下降,停药后可恢复。骨折的风险在群体水平没有观察到显著增加。
针对成年人的Partners PrEP研究和iPrEx研究均发现了骨密度的下降。Partners PrEP研究记录了PrEP组和安慰剂组参与者的骨形成、骨吸收和骨代谢标志物的变化,PrEP组的骨吸收标志物——血清C端肽的百分比显著增加[8]。
iPrEx研究显示,参与者PrEP开始后第24周和停药时,髋部和脊柱的骨密度下降,然而后续分析显示,骨密度的下降随停药而逆转,参与者髋部和脊柱骨密度每年分别增加1.13%和1.81%。平均来看,PrEP停止1年后,骨密度就会恢复到基线水平,不同年龄、基线骨密度和PrEP时长的参与者的恢复速度是一致的[9]。
Partners PrEP研究(上)和ANRS-IPERGAY试验(下)中,eGFR的变化趋势
在HIV/AIDS干预青少年药物试验网络(ATN)队列110(18-22岁)和113(15-17岁)中,只有ANT 110中的一例报告了肌酐水平的一级升高,且在后续的随访中恢复了正常[7]。
应对:在HIV感染的治疗指南中,对估计肌酐清除率(eCrCl)<60 mL/min的受试者不建议使用TDF或TDF/FTC,并且PrEP使用者需要每6个月至少检测一次肾功能,如果出现肾功能异常,需仔细检查肾功能异常的原因。如果怀疑是由TDF引起的,应考虑停药。对于急性肾损伤等需要紧急评估的症状,应咨询专业医务人员[7]。
TDF/FTC用于PrEP对骨密度影响较小
总体来看,服用TDF/FTC的受试者骨密度略有下降,停药后可恢复。骨折的风险在群体水平没有观察到显著增加。
针对成年人的Partners PrEP研究和iPrEx研究均发现了骨密度的下降。Partners PrEP研究记录了PrEP组和安慰剂组参与者的骨形成、骨吸收和骨代谢标志物的变化,PrEP组的骨吸收标志物——血清C端肽的百分比显著增加[8]。
iPrEx研究显示,参与者PrEP开始后第24周和停药时,髋部和脊柱的骨密度下降,然而后续分析显示,骨密度的下降随停药而逆转,参与者髋部和脊柱骨密度每年分别增加1.13%和1.81%。平均来看,PrEP停止1年后,骨密度就会恢复到基线水平,不同年龄、基线骨密度和PrEP时长的参与者的恢复速度是一致的[9]。
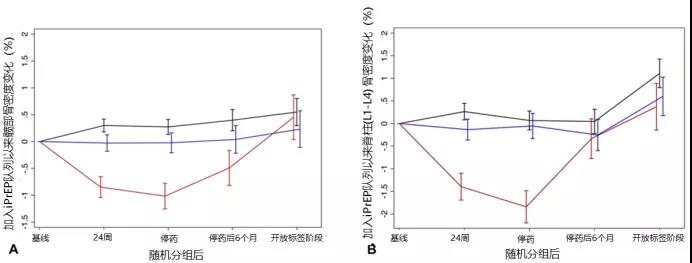 加入iPrEx队列后髋部(A)和脊柱(B)的骨密度随时间变化
相比成年人,青少年正处于骨骼发育的阶段,使用降低骨量或限制骨生长的药物可能会增加成年后骨折的风险。因此,ATN 110和113两个队列也记录了这些青少年PrEP使用者的骨密度变化。和成年人的变化相似,他们在使用PrEP期间的骨密度下降在停止后1年内有部分或完全的恢复[10]。
PrEP对性功能的影响小
目前没有证据显示TDF/FTC可致男性勃起障碍。但是患者自我报告认为PrEP药物的使用降低了他们与临时或稳定关系性伴侣的性关系质量。分析认为应用PrEP药物降低了发生性行为的门槛,跳过前戏使性关系质量下降可能是原因之一[11]。
此外,年龄增加、焦虑和抑郁等情绪变化也是勃起障碍的风险因素[12]。
存在勃起障碍的患者可能使用PDE-5抑制剂进行治疗,目前已知的会与PDE-5抑制剂产生有临床意义的药物相互作用的抗病毒药物主要为蛋白酶抑制剂[13]。未观察到TDF/FTC与PDE-5抑制剂之间存在有临床意义的药物相互作用。
PrEP对避孕或妊娠的影响小
口服避孕药者也可口服TDF/FTC进行PrEP。WHO指出TDF/FTC不会影响激素类避孕药的效果[14]。
对于计划妊娠者来说,TDF/FTC可在妊娠期使用。妊娠早期使用TDF/FTC作为PrEP的孕妇中未见妊娠相关不良事件增多[14]。一项2020年的研究对14个已经完成和正在进行的,评估怀孕或哺乳期间使用PrEP后母婴结局的试验进行了综合分析,结果显示TDF/FTC用于PrEP与不良妊娠或婴儿早期发育结局的风险增加无关[15]。
PrEP在跨性别者中的安全性
性激素与TDF/FTC之间无明显药物相互作用。
理论上,激素与TDF/FTC之间不会出现药物相互作用。
然而,近期一项小样本研究中观察到应用性激素的跨性别女性中,替诺福韦(TFV)/FTC暴露量较顺性别男性低约12-27%[16],但中位TFV/FTC浓度仍在治疗窗浓度范围内,且TFV-二磷酸盐/FTC-三磷酸盐的血药浓度水平与顺性别男性相似,提示TDF/FTC在应用性激素的跨性别女性中仍可达到保护浓度。接受性激素治疗的跨性别女性应继续TDF/FTC以降低HIV感染风险[17]。
肾功能评估需结合临床判断。
使用睾酮、雌二醇或抗雄激素等性激素治疗会改变身体成分和瘦体重,这会影响跨性别者的肌酐清除率和估计肾小球滤过率(eGFR)的计算。目前尚未有指南对跨性别者的肾功能指标计算进行规范,因此临床中需结合实际进行判断,必要时检测GFR以帮助临床决策[18]。
PrEP在乙型肝炎表面抗原阳性者(HBsAg+)中的安全性
性活跃人群和静脉注射吸毒人群通常也是乙型肝炎病毒(HBV)感染的高风险人群。HBV感染并不是PrEP的禁忌证。但由于PrEP药物同时对HBV感染也有治疗作用,对于HBsAg+者,在开展PrEP期间如果发生停药,则会有HBV反弹的风险,因此治疗前一定要检测HBV感染情况。医生需要做好医疗评估或者请肝病专家进行会诊[1]。
专家寄语
PrEP在近些年的实践中显示出了显著的降低新发HIV感染的效果,但是PrEP的推广和普及仍然存在难度和挑战。
从高风险人群自身的因素出发,除了药物成本和药物可及性之外,药物的安全性也是影响他们PrEP意愿的一大因素,因此,关于安全性的科学依据,既需要在推广过程中为大家普及,也需要在医生开具处方时向使用者重申,这样才能打破他们的顾虑,提高他们接受PrEP的意愿和对PrEP的依从性。
同时,我们应注意到,在一些特殊群体中,对PrEP安全性的研究还较为缺乏,实施PrEP的标准和要求也不准确或不明确,未来需要进行更多的研究,改变目前的境况。
总而言之,充分了解PrEP的安全性是推动PrEP大范围普及的必要一环。
加入iPrEx队列后髋部(A)和脊柱(B)的骨密度随时间变化
相比成年人,青少年正处于骨骼发育的阶段,使用降低骨量或限制骨生长的药物可能会增加成年后骨折的风险。因此,ATN 110和113两个队列也记录了这些青少年PrEP使用者的骨密度变化。和成年人的变化相似,他们在使用PrEP期间的骨密度下降在停止后1年内有部分或完全的恢复[10]。
PrEP对性功能的影响小
目前没有证据显示TDF/FTC可致男性勃起障碍。但是患者自我报告认为PrEP药物的使用降低了他们与临时或稳定关系性伴侣的性关系质量。分析认为应用PrEP药物降低了发生性行为的门槛,跳过前戏使性关系质量下降可能是原因之一[11]。
此外,年龄增加、焦虑和抑郁等情绪变化也是勃起障碍的风险因素[12]。
存在勃起障碍的患者可能使用PDE-5抑制剂进行治疗,目前已知的会与PDE-5抑制剂产生有临床意义的药物相互作用的抗病毒药物主要为蛋白酶抑制剂[13]。未观察到TDF/FTC与PDE-5抑制剂之间存在有临床意义的药物相互作用。
PrEP对避孕或妊娠的影响小
口服避孕药者也可口服TDF/FTC进行PrEP。WHO指出TDF/FTC不会影响激素类避孕药的效果[14]。
对于计划妊娠者来说,TDF/FTC可在妊娠期使用。妊娠早期使用TDF/FTC作为PrEP的孕妇中未见妊娠相关不良事件增多[14]。一项2020年的研究对14个已经完成和正在进行的,评估怀孕或哺乳期间使用PrEP后母婴结局的试验进行了综合分析,结果显示TDF/FTC用于PrEP与不良妊娠或婴儿早期发育结局的风险增加无关[15]。
PrEP在跨性别者中的安全性
性激素与TDF/FTC之间无明显药物相互作用。
理论上,激素与TDF/FTC之间不会出现药物相互作用。
然而,近期一项小样本研究中观察到应用性激素的跨性别女性中,替诺福韦(TFV)/FTC暴露量较顺性别男性低约12-27%[16],但中位TFV/FTC浓度仍在治疗窗浓度范围内,且TFV-二磷酸盐/FTC-三磷酸盐的血药浓度水平与顺性别男性相似,提示TDF/FTC在应用性激素的跨性别女性中仍可达到保护浓度。接受性激素治疗的跨性别女性应继续TDF/FTC以降低HIV感染风险[17]。
肾功能评估需结合临床判断。
使用睾酮、雌二醇或抗雄激素等性激素治疗会改变身体成分和瘦体重,这会影响跨性别者的肌酐清除率和估计肾小球滤过率(eGFR)的计算。目前尚未有指南对跨性别者的肾功能指标计算进行规范,因此临床中需结合实际进行判断,必要时检测GFR以帮助临床决策[18]。
PrEP在乙型肝炎表面抗原阳性者(HBsAg+)中的安全性
性活跃人群和静脉注射吸毒人群通常也是乙型肝炎病毒(HBV)感染的高风险人群。HBV感染并不是PrEP的禁忌证。但由于PrEP药物同时对HBV感染也有治疗作用,对于HBsAg+者,在开展PrEP期间如果发生停药,则会有HBV反弹的风险,因此治疗前一定要检测HBV感染情况。医生需要做好医疗评估或者请肝病专家进行会诊[1]。
专家寄语
PrEP在近些年的实践中显示出了显著的降低新发HIV感染的效果,但是PrEP的推广和普及仍然存在难度和挑战。
从高风险人群自身的因素出发,除了药物成本和药物可及性之外,药物的安全性也是影响他们PrEP意愿的一大因素,因此,关于安全性的科学依据,既需要在推广过程中为大家普及,也需要在医生开具处方时向使用者重申,这样才能打破他们的顾虑,提高他们接受PrEP的意愿和对PrEP的依从性。
同时,我们应注意到,在一些特殊群体中,对PrEP安全性的研究还较为缺乏,实施PrEP的标准和要求也不准确或不明确,未来需要进行更多的研究,改变目前的境况。
总而言之,充分了解PrEP的安全性是推动PrEP大范围普及的必要一环。
信息来源:【互联网】
排版编辑:【网摘】
信息发布:【徐强】
项目支持:【麦盖提县】
联系方式:13999198395 QQ\微信:137655 公益转编,侵删
新疆乌鲁木齐艾滋病检测、艾滋病阻断、HIV检测、HIV阻断、公益组织、感染者咨询 电话13999198395
| 姓名 |
电话 |
| HIV药物阻断 |
|
| HIV药物预防 |
| 采血结果查询 |
|
| HIV检测 |
|
| A友健康互助群 |
|
 |
 |
 |
|
 暴露前预防(pre-exposure prophylaxis, PrEP)是HIV综合预防策略中重要的预防方法之一,未感染者服用HIV治疗药物,在体内达到具保护性的药物浓度,以降低其接触病毒后的感染风险。
PrEP适用于未感染HIV的HIV感染者的配偶、与HIV高风险男性发生性行为的男性和跨性别女性,以及注射毒品人群等[1,2]。
目前富马酸替诺福韦二吡呋酯/恩曲他滨(TDF/FTC)是我国唯一获批HIV PrEP适应证的药物,也是WHO首个推荐用于HIV PrEP的口服药物,已在全球>50个国家和地区获批使用[3]。
应用十余年来,大量证据显示,PrEP在HIV暴露高风险人群中可降低至少90%的感染风险,美国、肯尼亚、乌干达等多个国家的横断面流行病学调查也都反映出PrEP推广后HIV新发感染病例数显著下降。
注意:实施PrEP前必须进行HIV检测,确保用药者没有感染HIV。
对已经感染但从未被诊断出的HIV阳性者进行PrEP可能会导致耐药发生,对其后续治疗产生严重的不良后果。
此外,基线实验室检查还需排除服用TDF/FTC的禁忌证和相关情况。
安全性是影响高风险人群PrEP的意愿和用药依从性的主要因素之一。TDF/FTC作为PrEP药物安全性如何?本文将为您解答。
TDF/FTC用于PrEP的整体安全性良好
TDF/FTC作为PrEP用药具有良好的安全性和耐受性。在PrEP刚开始的4周内,有少部分个体服药后可能会出现轻度的恶心、头痛、体重减轻或其他症状,但大多数症状在之后4周内会消失或缓解[1]。
应对:PrEP药物的不良反应并不常见,通常会在服用药物后的第一个月内得到缓解,医生或公共卫生人员可以推荐PrEP参与者使用非处方药来治疗头痛、恶心和肠胃气胀等症状[1]。
TDF/FTC用于PrEP对肾功能影响较小
总体来看,TDF用药后可致一过性的轻度肌酐清除率下降,停药后可恢复。
iPrEx研究的结果显示,PrEP组参与者的肌酐清除率(CrCl)有小幅的下降,这种下降从第4周开始出现,持续到停药,在停药后逐渐逆转。研究人员没有发现这种变化有种族、年龄和高血压病史的差异,不过会受到非甾体抗炎药物使用的影响[4]。
暴露前预防(pre-exposure prophylaxis, PrEP)是HIV综合预防策略中重要的预防方法之一,未感染者服用HIV治疗药物,在体内达到具保护性的药物浓度,以降低其接触病毒后的感染风险。
PrEP适用于未感染HIV的HIV感染者的配偶、与HIV高风险男性发生性行为的男性和跨性别女性,以及注射毒品人群等[1,2]。
目前富马酸替诺福韦二吡呋酯/恩曲他滨(TDF/FTC)是我国唯一获批HIV PrEP适应证的药物,也是WHO首个推荐用于HIV PrEP的口服药物,已在全球>50个国家和地区获批使用[3]。
应用十余年来,大量证据显示,PrEP在HIV暴露高风险人群中可降低至少90%的感染风险,美国、肯尼亚、乌干达等多个国家的横断面流行病学调查也都反映出PrEP推广后HIV新发感染病例数显著下降。
注意:实施PrEP前必须进行HIV检测,确保用药者没有感染HIV。
对已经感染但从未被诊断出的HIV阳性者进行PrEP可能会导致耐药发生,对其后续治疗产生严重的不良后果。
此外,基线实验室检查还需排除服用TDF/FTC的禁忌证和相关情况。
安全性是影响高风险人群PrEP的意愿和用药依从性的主要因素之一。TDF/FTC作为PrEP药物安全性如何?本文将为您解答。
TDF/FTC用于PrEP的整体安全性良好
TDF/FTC作为PrEP用药具有良好的安全性和耐受性。在PrEP刚开始的4周内,有少部分个体服药后可能会出现轻度的恶心、头痛、体重减轻或其他症状,但大多数症状在之后4周内会消失或缓解[1]。
应对:PrEP药物的不良反应并不常见,通常会在服用药物后的第一个月内得到缓解,医生或公共卫生人员可以推荐PrEP参与者使用非处方药来治疗头痛、恶心和肠胃气胀等症状[1]。
TDF/FTC用于PrEP对肾功能影响较小
总体来看,TDF用药后可致一过性的轻度肌酐清除率下降,停药后可恢复。
iPrEx研究的结果显示,PrEP组参与者的肌酐清除率(CrCl)有小幅的下降,这种下降从第4周开始出现,持续到停药,在停药后逐渐逆转。研究人员没有发现这种变化有种族、年龄和高血压病史的差异,不过会受到非甾体抗炎药物使用的影响[4]。
 iPrEx研究PrEP组参与者的肌酐清除率(CrCl)变化
估计肾小球滤过率(eGFR)的变化与CrCl类似,Partners PrEP研究[5]和ANRS-IPERGAY试验数据分析[6]的结果均显示,TDF/FTC用于PrEP肾脏安全性良好,PrEP期间eGFR有小幅的变化,且能够在停药后恢复。
iPrEx研究PrEP组参与者的肌酐清除率(CrCl)变化
估计肾小球滤过率(eGFR)的变化与CrCl类似,Partners PrEP研究[5]和ANRS-IPERGAY试验数据分析[6]的结果均显示,TDF/FTC用于PrEP肾脏安全性良好,PrEP期间eGFR有小幅的变化,且能够在停药后恢复。
 Partners PrEP研究(上)和ANRS-IPERGAY试验(下)中,eGFR的变化趋势
在HIV/AIDS干预青少年药物试验网络(ATN)队列110(18-22岁)和113(15-17岁)中,只有ANT 110中的一例报告了肌酐水平的一级升高,且在后续的随访中恢复了正常[7]。
应对:在HIV感染的治疗指南中,对估计肌酐清除率(eCrCl)<60 mL/min的受试者不建议使用TDF或TDF/FTC,并且PrEP使用者需要每6个月至少检测一次肾功能,如果出现肾功能异常,需仔细检查肾功能异常的原因。如果怀疑是由TDF引起的,应考虑停药。对于急性肾损伤等需要紧急评估的症状,应咨询专业医务人员[7]。
TDF/FTC用于PrEP对骨密度影响较小
总体来看,服用TDF/FTC的受试者骨密度略有下降,停药后可恢复。骨折的风险在群体水平没有观察到显著增加。
针对成年人的Partners PrEP研究和iPrEx研究均发现了骨密度的下降。Partners PrEP研究记录了PrEP组和安慰剂组参与者的骨形成、骨吸收和骨代谢标志物的变化,PrEP组的骨吸收标志物——血清C端肽的百分比显著增加[8]。
iPrEx研究显示,参与者PrEP开始后第24周和停药时,髋部和脊柱的骨密度下降,然而后续分析显示,骨密度的下降随停药而逆转,参与者髋部和脊柱骨密度每年分别增加1.13%和1.81%。平均来看,PrEP停止1年后,骨密度就会恢复到基线水平,不同年龄、基线骨密度和PrEP时长的参与者的恢复速度是一致的[9]。
Partners PrEP研究(上)和ANRS-IPERGAY试验(下)中,eGFR的变化趋势
在HIV/AIDS干预青少年药物试验网络(ATN)队列110(18-22岁)和113(15-17岁)中,只有ANT 110中的一例报告了肌酐水平的一级升高,且在后续的随访中恢复了正常[7]。
应对:在HIV感染的治疗指南中,对估计肌酐清除率(eCrCl)<60 mL/min的受试者不建议使用TDF或TDF/FTC,并且PrEP使用者需要每6个月至少检测一次肾功能,如果出现肾功能异常,需仔细检查肾功能异常的原因。如果怀疑是由TDF引起的,应考虑停药。对于急性肾损伤等需要紧急评估的症状,应咨询专业医务人员[7]。
TDF/FTC用于PrEP对骨密度影响较小
总体来看,服用TDF/FTC的受试者骨密度略有下降,停药后可恢复。骨折的风险在群体水平没有观察到显著增加。
针对成年人的Partners PrEP研究和iPrEx研究均发现了骨密度的下降。Partners PrEP研究记录了PrEP组和安慰剂组参与者的骨形成、骨吸收和骨代谢标志物的变化,PrEP组的骨吸收标志物——血清C端肽的百分比显著增加[8]。
iPrEx研究显示,参与者PrEP开始后第24周和停药时,髋部和脊柱的骨密度下降,然而后续分析显示,骨密度的下降随停药而逆转,参与者髋部和脊柱骨密度每年分别增加1.13%和1.81%。平均来看,PrEP停止1年后,骨密度就会恢复到基线水平,不同年龄、基线骨密度和PrEP时长的参与者的恢复速度是一致的[9]。
 加入iPrEx队列后髋部(A)和脊柱(B)的骨密度随时间变化
相比成年人,青少年正处于骨骼发育的阶段,使用降低骨量或限制骨生长的药物可能会增加成年后骨折的风险。因此,ATN 110和113两个队列也记录了这些青少年PrEP使用者的骨密度变化。和成年人的变化相似,他们在使用PrEP期间的骨密度下降在停止后1年内有部分或完全的恢复[10]。
PrEP对性功能的影响小
目前没有证据显示TDF/FTC可致男性勃起障碍。但是患者自我报告认为PrEP药物的使用降低了他们与临时或稳定关系性伴侣的性关系质量。分析认为应用PrEP药物降低了发生性行为的门槛,跳过前戏使性关系质量下降可能是原因之一[11]。
此外,年龄增加、焦虑和抑郁等情绪变化也是勃起障碍的风险因素[12]。
存在勃起障碍的患者可能使用PDE-5抑制剂进行治疗,目前已知的会与PDE-5抑制剂产生有临床意义的药物相互作用的抗病毒药物主要为蛋白酶抑制剂[13]。未观察到TDF/FTC与PDE-5抑制剂之间存在有临床意义的药物相互作用。
PrEP对避孕或妊娠的影响小
口服避孕药者也可口服TDF/FTC进行PrEP。WHO指出TDF/FTC不会影响激素类避孕药的效果[14]。
对于计划妊娠者来说,TDF/FTC可在妊娠期使用。妊娠早期使用TDF/FTC作为PrEP的孕妇中未见妊娠相关不良事件增多[14]。一项2020年的研究对14个已经完成和正在进行的,评估怀孕或哺乳期间使用PrEP后母婴结局的试验进行了综合分析,结果显示TDF/FTC用于PrEP与不良妊娠或婴儿早期发育结局的风险增加无关[15]。
PrEP在跨性别者中的安全性
性激素与TDF/FTC之间无明显药物相互作用。
理论上,激素与TDF/FTC之间不会出现药物相互作用。
然而,近期一项小样本研究中观察到应用性激素的跨性别女性中,替诺福韦(TFV)/FTC暴露量较顺性别男性低约12-27%[16],但中位TFV/FTC浓度仍在治疗窗浓度范围内,且TFV-二磷酸盐/FTC-三磷酸盐的血药浓度水平与顺性别男性相似,提示TDF/FTC在应用性激素的跨性别女性中仍可达到保护浓度。接受性激素治疗的跨性别女性应继续TDF/FTC以降低HIV感染风险[17]。
肾功能评估需结合临床判断。
使用睾酮、雌二醇或抗雄激素等性激素治疗会改变身体成分和瘦体重,这会影响跨性别者的肌酐清除率和估计肾小球滤过率(eGFR)的计算。目前尚未有指南对跨性别者的肾功能指标计算进行规范,因此临床中需结合实际进行判断,必要时检测GFR以帮助临床决策[18]。
PrEP在乙型肝炎表面抗原阳性者(HBsAg+)中的安全性
性活跃人群和静脉注射吸毒人群通常也是乙型肝炎病毒(HBV)感染的高风险人群。HBV感染并不是PrEP的禁忌证。但由于PrEP药物同时对HBV感染也有治疗作用,对于HBsAg+者,在开展PrEP期间如果发生停药,则会有HBV反弹的风险,因此治疗前一定要检测HBV感染情况。医生需要做好医疗评估或者请肝病专家进行会诊[1]。
专家寄语
PrEP在近些年的实践中显示出了显著的降低新发HIV感染的效果,但是PrEP的推广和普及仍然存在难度和挑战。
从高风险人群自身的因素出发,除了药物成本和药物可及性之外,药物的安全性也是影响他们PrEP意愿的一大因素,因此,关于安全性的科学依据,既需要在推广过程中为大家普及,也需要在医生开具处方时向使用者重申,这样才能打破他们的顾虑,提高他们接受PrEP的意愿和对PrEP的依从性。
同时,我们应注意到,在一些特殊群体中,对PrEP安全性的研究还较为缺乏,实施PrEP的标准和要求也不准确或不明确,未来需要进行更多的研究,改变目前的境况。
总而言之,充分了解PrEP的安全性是推动PrEP大范围普及的必要一环。
加入iPrEx队列后髋部(A)和脊柱(B)的骨密度随时间变化
相比成年人,青少年正处于骨骼发育的阶段,使用降低骨量或限制骨生长的药物可能会增加成年后骨折的风险。因此,ATN 110和113两个队列也记录了这些青少年PrEP使用者的骨密度变化。和成年人的变化相似,他们在使用PrEP期间的骨密度下降在停止后1年内有部分或完全的恢复[10]。
PrEP对性功能的影响小
目前没有证据显示TDF/FTC可致男性勃起障碍。但是患者自我报告认为PrEP药物的使用降低了他们与临时或稳定关系性伴侣的性关系质量。分析认为应用PrEP药物降低了发生性行为的门槛,跳过前戏使性关系质量下降可能是原因之一[11]。
此外,年龄增加、焦虑和抑郁等情绪变化也是勃起障碍的风险因素[12]。
存在勃起障碍的患者可能使用PDE-5抑制剂进行治疗,目前已知的会与PDE-5抑制剂产生有临床意义的药物相互作用的抗病毒药物主要为蛋白酶抑制剂[13]。未观察到TDF/FTC与PDE-5抑制剂之间存在有临床意义的药物相互作用。
PrEP对避孕或妊娠的影响小
口服避孕药者也可口服TDF/FTC进行PrEP。WHO指出TDF/FTC不会影响激素类避孕药的效果[14]。
对于计划妊娠者来说,TDF/FTC可在妊娠期使用。妊娠早期使用TDF/FTC作为PrEP的孕妇中未见妊娠相关不良事件增多[14]。一项2020年的研究对14个已经完成和正在进行的,评估怀孕或哺乳期间使用PrEP后母婴结局的试验进行了综合分析,结果显示TDF/FTC用于PrEP与不良妊娠或婴儿早期发育结局的风险增加无关[15]。
PrEP在跨性别者中的安全性
性激素与TDF/FTC之间无明显药物相互作用。
理论上,激素与TDF/FTC之间不会出现药物相互作用。
然而,近期一项小样本研究中观察到应用性激素的跨性别女性中,替诺福韦(TFV)/FTC暴露量较顺性别男性低约12-27%[16],但中位TFV/FTC浓度仍在治疗窗浓度范围内,且TFV-二磷酸盐/FTC-三磷酸盐的血药浓度水平与顺性别男性相似,提示TDF/FTC在应用性激素的跨性别女性中仍可达到保护浓度。接受性激素治疗的跨性别女性应继续TDF/FTC以降低HIV感染风险[17]。
肾功能评估需结合临床判断。
使用睾酮、雌二醇或抗雄激素等性激素治疗会改变身体成分和瘦体重,这会影响跨性别者的肌酐清除率和估计肾小球滤过率(eGFR)的计算。目前尚未有指南对跨性别者的肾功能指标计算进行规范,因此临床中需结合实际进行判断,必要时检测GFR以帮助临床决策[18]。
PrEP在乙型肝炎表面抗原阳性者(HBsAg+)中的安全性
性活跃人群和静脉注射吸毒人群通常也是乙型肝炎病毒(HBV)感染的高风险人群。HBV感染并不是PrEP的禁忌证。但由于PrEP药物同时对HBV感染也有治疗作用,对于HBsAg+者,在开展PrEP期间如果发生停药,则会有HBV反弹的风险,因此治疗前一定要检测HBV感染情况。医生需要做好医疗评估或者请肝病专家进行会诊[1]。
专家寄语
PrEP在近些年的实践中显示出了显著的降低新发HIV感染的效果,但是PrEP的推广和普及仍然存在难度和挑战。
从高风险人群自身的因素出发,除了药物成本和药物可及性之外,药物的安全性也是影响他们PrEP意愿的一大因素,因此,关于安全性的科学依据,既需要在推广过程中为大家普及,也需要在医生开具处方时向使用者重申,这样才能打破他们的顾虑,提高他们接受PrEP的意愿和对PrEP的依从性。
同时,我们应注意到,在一些特殊群体中,对PrEP安全性的研究还较为缺乏,实施PrEP的标准和要求也不准确或不明确,未来需要进行更多的研究,改变目前的境况。
总而言之,充分了解PrEP的安全性是推动PrEP大范围普及的必要一环。





