随着新冠病毒疫苗研发成功并在世界各地陆续开始接种,人们不禁要问:■ 为什么新冠疫苗能以如此快的速度研制出来,而艾滋病已经存在40年却还没有疫苗问世?实际上,HIV疫苗的研发工作虽然屡屡失败受挫却从未被放弃,全球包括中国在内的数支研发队伍在不同的临床试验阶段推进HIV疫苗的研发进程。
随着科研团队对HIV病毒的了解更加深入,以及国际交流合作的不断加强,第一支HIV疫苗的诞生也许将不再遥遥无期。

联合国艾滋病规划署高级科学顾问、伦敦卫生与热带医学院 (London School of Hygiene and Tropical Medicine) 国际卫生与传染病学教授Peter Godfrey-Faussett认为新冠肺炎疫情在短时间内的快速传播和对社会经济造成的巨大影响成为疫苗迅速研发的推动力。

造成新冠肺炎的新冠肺炎病毒和HIV是两种截然不同的病毒,他们造成传播和人体对其的反应也有不同。
新冠肺炎病毒造成感染的是一种比较典型的感染过程,其引发的疾病虽然复杂,有时甚至神秘,但几乎每个感染新冠肺炎病毒的人都会产生针对刺突蛋白的抗体,这种抗体会中和、清除病毒,从而使病人康复。
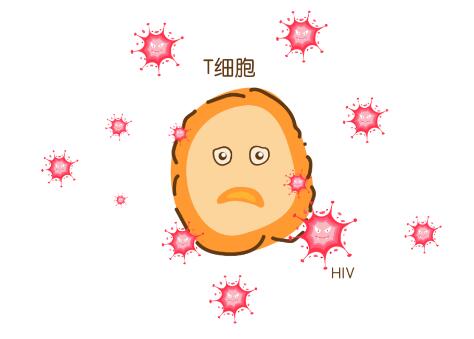
HIV感染则不同。感染HIV的人虽然也都会产生抗体,并且我们在定期的HIV检测中也会观察到这些抗体,但遗憾的是,这些抗体不足以中和HIV,没有人能清除感染。HIV外覆包膜,其活性位点包埋于深处,因此抗体很难与它接触而施加影响。
随着时间的推移,有些HIV感染者体内确实会产生能够中和HIV的抗体,但这可能需要很多年的时间。

此外,HIV是一种逆转录病毒,可以复制自己的遗传密码,并将其整合到人类遗传密码中的病毒。在它复制自己遗传密码的过程中,会犯很多错误,也就是我们经常提到的病毒变异。这种变异使得先前已经产生的抗体难以起到保护作用。亦是因为如此,一个人体内产生的HIV中和抗体往往不能中和另一个人体内的HIV病毒。 “我们现在已经发现了一些所谓的广谱中和抗体,即能中和多种不同HIV毒株的抗体。研究人员们目前正在研究这些抗体,并试图了解它们是否能保护人们免于感染不同的HIV毒株,” Godfrey-Faussett说:“如果我们能够在感染HIV之前产生更广泛的中和抗体,广谱中和抗体则可能成为研制HIV疫苗过程的一个重要组分。” 除了产生抗体的体液免疫,人体内还有一套由T细胞主导的细胞免疫。Godfrey-Faussett还强调,与新冠肺炎病毒不同,或者说部分不同,HIV会攻击T细胞,减低细胞免疫的水平。细胞免疫更难研究,而且变化更大。这使得研发HIV疫苗的过程有别于研发新冠病毒疫苗的过程,且更加困难。
中国疾病预防控制中心艾滋病首席专家邵一鸣教授长期从事HIV疫苗的研发,他用狄更斯的《双城记》(Tale of Two Cities)这个为人熟知且更加通俗易懂的比喻来解释两种病毒的不同之处。
他提出,根据病原体的性质,不管是病毒还是细菌,可以分成两大类,分别位于A城和B城。

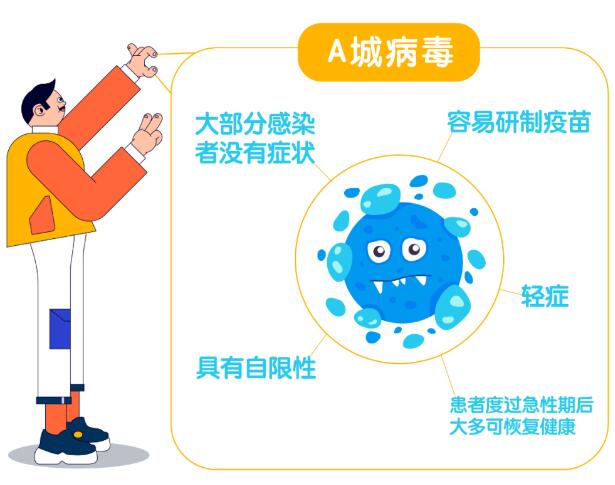
对A城的病原体容易研制疫苗,这类病原体的特点是在自然感染时能够诱导宿主产生保护性免疫,它的表征是绝大部分感染者没有症状的,或者是轻症,新冠肺炎病毒就是属于这一类,疾病具有自限性,患者度过急性期后大多可恢复健康。 这类疾病预后良好的机制是宿主免疫系统在进化上强于病原体,能够控制其感染和致病力,并很快清除病原体。A城疫苗之所以容易研制,就是借助了进化的力量,依靠我们强于病原体的免疫系统才成功的。实际上疫苗研发只要发现病原,知道是“谁”引起的这个疾病,然后对其进行减毒、灭活、或者按照它的密码子研制基因工程疫苗,就可以了,而且大都能成功。这在新冠病毒疫苗的研发中表现得非常淋漓尽致。
例如,中国企业在拿到疾控机构分离的新冠病毒后,马上对其进行培养、灭活和纯化,疫苗就研制出来了。美欧企业在中国公布新冠病毒基因组序列24小时内,即开始mRNA疫苗的化学合成和修饰,也产出了疫苗。这也是灭活和mRNA疫苗能在一年内成功通过各期临床试验,投入使用的原因。其他基因工程疫苗虽然工艺复杂,再增加几个月的时间也都成功了。尽管各类疫苗在对轻症病例的保护程度有所差别,但是对住院、重症的死亡病例的保护都在80%以上,在保护医疗资源不被挤兑、减轻病人疾患和挽救生命方面没有根本的差别。 与之正相反,HIV属于B城的病原体,它在自然感染时不能够诱导有效的保护性免疫,其表征是绝大部分感染者都有进行性加重的症状, 疾病无自限性,不经特效抗病毒药物治疗几乎所有艾滋病患者都会死亡。这也是艾滋病在抗病毒药物发明之前被称之为“超级癌症”的原因。
B城病原体之所以难以控制、预后很差,原因是在进化上宿主免疫系统弱于病原体,研制疫苗无法借助进化的优势,无法按照常规疫苗技术路线获得成功,必须另辟蹊径开展创新研究,克服进化劣势,增强疫苗免疫原性,最终控制住病毒。
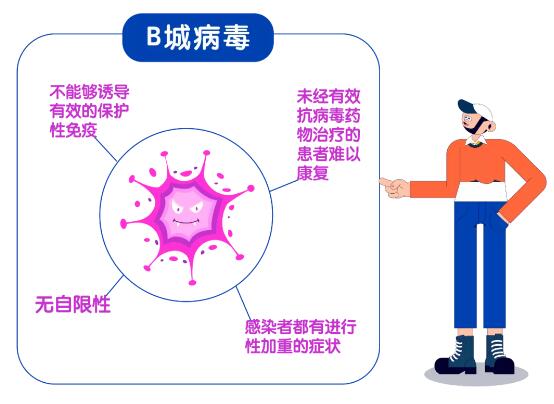
从严格意义上来讲,针对B城病原体的疫苗世界上没有成功的案例。尽管难度非常大,但是非常值得探索。因为一旦艾滋病疫苗成功,将会极大地推动整个B城病原疫苗的研制,就像艾滋病药物的突破,带动了整个抗病毒药物的发展一样。
在去年2月份之前,国际上有两个HIV疫苗在推进三期临床试验。第一个是美国国立卫生研究院(NIH)推动的。
之前NIH在泰国普通人群开展了命名为RV144的III期临床实验,得到了31%的保护率数据。这是艾滋病疫苗几十年来唯一的人体保护数据。但是由于31%的保护率太低,对泰国这个疾病新发感染很低的国家意义不大。南非认为31%的保护数据对本国有意义,所以NIH就把泰国流行株疫苗换成非洲流行株,又做了一个三期临床HVTN702。
 在全球忙于防控新冠疫情的2020年二月,NIH宣布了这个试验的失败,因为疫苗组和安慰剂组的HIV感染率无差异,疫苗未观察到保护作用。
另外一个三期临床试验是强生公司与哈佛大学合作的腺病毒26载体疫苗与gp140蛋白疫苗的复合疫苗试验。试验的结果将于2022/2023年发布。
在全球忙于防控新冠疫情的2020年二月,NIH宣布了这个试验的失败,因为疫苗组和安慰剂组的HIV感染率无差异,疫苗未观察到保护作用。
另外一个三期临床试验是强生公司与哈佛大学合作的腺病毒26载体疫苗与gp140蛋白疫苗的复合疫苗试验。试验的结果将于2022/2023年发布。
中国的艾滋病疫苗的研究从20年前的863计划开始,当时主要是邵一鸣教授领导的团队在进行,研制的是复合性疫苗—用核酸疫苗做初免,然后用痘病毒载体的疫苗加强。 在中国十一五、十二五、十三五这15年间,清华大学的张林琦教授,吉林大学的于晓方教授、孔维教授,还有中疾控曾毅院士团队,都先后开始HIV疫苗的研发,所以中国目前一共4个研发团队。曾毅院士团队完成了治疗性疫苗的一期临床试验,邵一鸣教授团队完成了三个一期的临床试验和两个二期临床试验。据邵一鸣教授介绍,这两个二期临床试验的区别在于:通过不同的接种剂次和剂型,激发和诱导更高的抗体保护水平,包括一部分中和抗体。邵一鸣教授计划今年年底启动三期临床,目前来看,这很可能是全球领域的三期临床试验。 据邵一鸣教授介绍,中国HIV疫苗研发的技术路线有其独特性和创新性。一是与中国农科院沈荣显院士长期合作,通过系统研究沈院士成功研制的第一个慢病毒的疫苗(HIV属于慢病毒),尤其是其在减毒过程中的蛋白结构变化,改造了HIV的免疫原并获得良好效果。二是选用作为中国天花疫苗的天坛株痘苗病毒,用其研制了复制型载体HIV疫苗,并在国际上第一个完成了复制型病毒载体HIV疫苗的二期临床试验。
鉴于中国疾控中心(CCDC)邵一鸣团队研制的DNA疫苗/复制型痘病毒(DNA/rTV)HIV疫苗,与安东尼·福奇领导的国家过敏症和传染病研究所(NIAID)正在推进的RV144试验(蛋白疫苗/非复制型痘病毒)有良好的技术互补性。CCDC与NIAID签署了合作备忘录,开展中美HIV疫苗联合临床试验, 即“艾滋病疫苗鸡尾酒”,先用中国DNA疫苗初免,再用rTV疫苗和NIAID的蛋白疫苗进行加强免疫。该项目获得了两国政府的批准和支持。 2019年底,NIAID的蛋白疫苗在美国完成了一期临床试验。目前,中美双方正在准备申报资料,向中国药监局提出中美三个疫苗联合临床试验的申请。
邵一鸣教授希望,接下来的进度能够加快,在获得中国药监局批准后开展中美联合的一二期临床,如果试验结果好,则尽快推动三期临床试验,为中国DNA/rTV疫苗的三期临床试验提供一个技术互补的试验结果。他说,中美两国的疫苗有很好的基础互补,“艾滋病这样一个人类面临的重大挑战,应该通过进一步加强国际合作来加以突破。”
在过去的十年里,全球每年会有大约十几亿美元用于研发HIV疫苗,大约占全球艾滋病防治预算的5%。据了解,中国在十四五阶段还会继续支持HIV疫苗的研发。另外,邵一鸣教授强调政府和私营部门合作(Public Private Partnership)的重要性。
联合国艾滋病规划署一直以来发挥全球领导力的作用,积极推动创新和疫苗研发,动员政府支持和社区参与。在最新通过的2021-2026全球艾滋病战略中,疫苗研发是一项重要工作,需要加大投资力度,同时,新冠肺炎疫苗的研发经验也可以带来启发。也许,艾滋病病毒疫苗研发成功的日子离我们并不遥远。








 在全球忙于防控新冠疫情的2020年二月,NIH宣布了这个试验的失败,因为疫苗组和安慰剂组的HIV感染率无差异,疫苗未观察到保护作用。
另外一个三期临床试验是强生公司与哈佛大学合作的腺病毒26载体疫苗与gp140蛋白疫苗的复合疫苗试验。试验的结果将于2022/2023年发布。
在全球忙于防控新冠疫情的2020年二月,NIH宣布了这个试验的失败,因为疫苗组和安慰剂组的HIV感染率无差异,疫苗未观察到保护作用。
另外一个三期临床试验是强生公司与哈佛大学合作的腺病毒26载体疫苗与gp140蛋白疫苗的复合疫苗试验。试验的结果将于2022/2023年发布。











