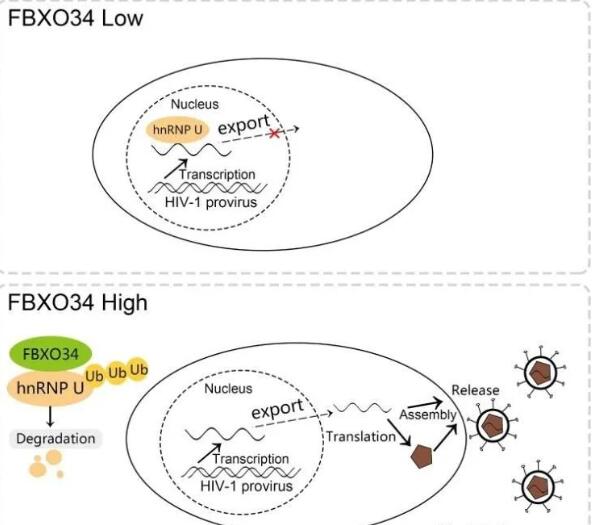
近日,我院朱焕章教授团队在国际著名杂志 Emerging Microbe & Infection上在线发表了题为“ FBXO34 promotes latent HIV-1 activation by post-transcriptional modulation”的研究论文,报道了新鉴定出的 E3泛素连接酶 FBXO34通过促进 hnRNP U泛素化引导其降解,从而消除 hnRNP U对 HIV-1 mRNA翻译的抑制导致的 HIV-1潜伏。该发现为HIV潜伏感染的分子机制提供了新的认识,并可能为艾滋病功能性治愈提供了潜在的药物干预靶点。在该研究中,研究者首先利用全基因组CRISPR/Cas9激活文库在HIV-1潜伏细胞系C11中筛选到了与HIV-1潜伏相关的宿主基因FBXO34,发现FBXO34表达在多种HIV-1潜伏感染细胞系和原代CD4+T细胞潜伏模型能促进潜伏HIV-1激活。之后,研究者通过免疫共沉淀和质谱的方法鉴定了FBXO34的底物hnRNP U,并发现FBXO34通过介导hnRNP U泛素化使其降解来促进HIV-1潜伏激活, 证实hnRNP U能够通过结合HIV-1mRNA的Rev位点在转录后水平上促进HIV-1潜伏, 而hnRNP U的1-339位氨基酸对其结合HIV-1 mRNA起关键作用。最后,研究者在经ART治疗的病人的外周血CD4+T细胞中发现hnRNP U的表达显著增加,预示着FBXO34/hnRNP U作用轴可能通过抑制HIV-1转录促进其潜伏。近几年来,朱焕章团队以HIV潜伏分子机制及其干预技术为主要研究方向,先后发现HIV潜伏感染的关键基因PEBP1和FKBP3(EMBO Reports 2020;21:e49305; mBio,2021;12(4):e0079521), 以及发现组蛋白甲基化转移酶GLP以及miRNAs( miR-196b and miR-1290)在HIV潜伏的维持中起重要作用(Virology,2013,440,182-189;Virology, 2015;486:228-38)。2013年在国际上首次提出并证实基因编辑靶向切除HIV前病毒的“斩草除根”治疗策略的可行性(Nucleic Acids Res., 2013;41:7771-82),并获得基因编辑治疗疾病的首个中国发明专利;成功实现诱导型锌指核酸酶(ZFN)靶向切除近9.8 kb HIV前病毒(Molecular Therapy-Nucleic Acids,2018,12,67-74);在国际上较早利用基因编辑技术三大技术,先后获得能靶向永久沉默或干预HIV潜伏的ZFP、TALE、dCas9基因治疗载体系统(Molecular Therapy. 2016,24:508-21 ;Molecular Therapy-Nucleic Acids. 2017,17:233-42; Gene Ther. 2014, 21:490-95;AIDS Res Hum Retroviruses,2015,98-106);发现携带PD-1显性负性受体的抗HIV CAR T可提高其体内的功能活性(Front Microbiol. 2021 Jul 6;12:684016)。
复旦大学生命科学学院博士后杨辛毅为论文第一作者,朱焕章教授为通讯作者。相关研究得到了国家自然科学基金和中国博后科学基金的资助。




