低病毒血症(LLV)
抗病毒治疗改善了HIV感染者的生存状态,但低病毒血症(low-level viremia, LLV)的存在仍会带来很多危害。
高度关注并认真面对LLV,才能知道如何避免和管理LLV。为此专门推出了5篇“HIV低病毒血症”系列文章。
前两篇文章中,我们已了解规范化抗病毒治疗后,仍有1/5-1/3的HIV感染出现符合WHO定义的LLV,LLV明确增加病毒学失败以及耐药的风险,其风险随着病毒载量(VL)的增加而增加。
这是本系列的第三篇文章,我们将一起探讨LLV对患者免疫重建以及长期治疗结局的影响。
研究显示,未经抗病毒治疗的HIV感染者从艾滋病(acquired immune deficiency syndrome,AIDS)发病后的2年生存率不到50%,6年生存率仅为18%[1]。而根据瑞典的一项全国性队列研究显示,VL>1000copies/ml的HIV感染者,全因死亡率增加了6.7倍[2]。
2018版《中国艾滋病诊疗指南》明确提出治疗HIV的目标,除了最大程度地抑制病毒复制使VL降低至检测下限并减少病毒变异,还要求降低HIV感染者的发病率和死亡率、减少非AIDS相关疾病的发病率和病死率,使患者获得正常的期望寿命;以及重建或者改善免疫功能,减少异常的免疫激活[3]。
那么LLV(依据WHO定义的50copies/ml<VL<1000copies/ml)——这个曾经的“灰色地带”,是否LLV的持续会对患者的死亡率和免疫功能重建产生影响,今天的文章将带我们畅游LLV患者免疫和临床结局的相关数据。
对于LLV患者来说,LLV与这几个治疗目标又有着什么样的关系呢?
尽管抗病毒治疗能够抑制HIV的复制,提高外周血中CD4+T 细胞的数量,重建患者的免疫功能。但对于LLV的患者来说,却往往不能取得良好的免疫重建。
广州市第八人民医院进行的一项回顾性队列研究发现,与抗病毒治疗后病毒完全抑制者相比,LLV患者不仅出现病毒学治疗失败的发生率更高,免疫恢复功能也更缓慢,患者的CD8+细胞下降以及CD4/CD8比值的恢复都显著叫病毒学持续抑制的患者减缓[4]。
2005年《The Journal of Infectious Diseases》发表“在接受抗病毒治疗的HIV感染者中,LLV会阻碍患者免疫重建” 的文章较详细的阐述了LLV的持续状态对CD4+细胞的影响[5]。
在这项研究中,研究人员发现,较高的VL与CD4+细胞增长减少独立相关(P<0.01),且较高的VL水平也与活化的CD8+细胞、CD38+细胞增加相关(P<0.05),而较高活化的CD8+细胞、CD38+细胞又与CD4+增长降低独立相关(P<0.05)。
LLV确实会导致HIV感染者免疫重建不良,而这种免疫重建不良与LLV患者的异常免疫激活有关。
同时期发表在AIDS上的另一项研究也曾得出过相似的结果[6]。
研究人员发现,在持续低水平病毒血症(pLLV)的状况下,免疫激活的细胞标志物持续升高。相比于VL<50copies/ml的感染者,VL介于50-1000copies/ml的HIV感染者有更高的 CD8+T 细胞激活。
事实上,免疫重建不良是由多方面因素造成的。
首先,骨髓受损、胸腺输出能力下降会导致CD4+T细胞计数难以复常。第二个可能的机制是免疫激活。研究表明,免疫激活是HIV感染和疾病进展的主要特征之一。免疫激活的原因多且复杂,一种观点认为,HIV感染者中残留的HIV复制,造成了持续的免疫活化。另一种观点认为,HIV感染者肠黏膜破坏造成菌群移位,炎性介质不断进入循环,形成了慢性的免疫激活,持续的免疫活化可能会导致CD4+T细胞耗竭[7]。
第三个可能的机制是持续的HIV病毒复制所致。最后,性别和遗传多样性也可能会影响免疫重建。
 免疫重建不良只是LLV对临床影响的冰山一角。通过回顾过往的研究,我们发现,LLV也同样会对临床结局产生不良影响。
LLV对临床结局的影响
此前,为了探讨LLV对接受抗病毒治疗的患者的AIDS/死亡事件和严重非AIDS事件的长期影响,西班牙研究者进行了一项前瞻性多中心研究,观察了不同VL水平患者AIDS/死亡事件和严重非AIDS事件5年累计发生率[8]。
在这项研究中,研究人员分析了西班牙艾滋病研究网络(CoRIS)队列中2004年至2015年开始接受ART治疗,并达到VL<50copies/ml的5986例患者。
研究人员将患者分为三组:LLV 50-199copies/ml组、LLV 200-499copies/ml组和无LLV组(整个随访过程中没有出现前两组的情况)。
其中,LLV 50-199copies/ml定义为连续2次50copies/ml≤VL≤199copies/ml;LLV 200-499定义为连续2次50copies/ml≤VL≤499copies/ml且至少一次200copies/ml≤VL≤VL499copies/ml。
在5986例患者中,共有237例患者出现LLV 50-199copies/ml,占比4.0%,168例患者出现LLV 200-499copies/ml,占比2.8%。共有171名患者死亡或发生AIDS事件,280人出现了病毒学失败。
在多因素分析中,研究人员发现,LLV 200-499copies/ml与AIDS/死亡事件5年累计发生率增加显著相关(aHR 2.89,95%CI 1.41-5.92)。
免疫重建不良只是LLV对临床影响的冰山一角。通过回顾过往的研究,我们发现,LLV也同样会对临床结局产生不良影响。
LLV对临床结局的影响
此前,为了探讨LLV对接受抗病毒治疗的患者的AIDS/死亡事件和严重非AIDS事件的长期影响,西班牙研究者进行了一项前瞻性多中心研究,观察了不同VL水平患者AIDS/死亡事件和严重非AIDS事件5年累计发生率[8]。
在这项研究中,研究人员分析了西班牙艾滋病研究网络(CoRIS)队列中2004年至2015年开始接受ART治疗,并达到VL<50copies/ml的5986例患者。
研究人员将患者分为三组:LLV 50-199copies/ml组、LLV 200-499copies/ml组和无LLV组(整个随访过程中没有出现前两组的情况)。
其中,LLV 50-199copies/ml定义为连续2次50copies/ml≤VL≤199copies/ml;LLV 200-499定义为连续2次50copies/ml≤VL≤499copies/ml且至少一次200copies/ml≤VL≤VL499copies/ml。
在5986例患者中,共有237例患者出现LLV 50-199copies/ml,占比4.0%,168例患者出现LLV 200-499copies/ml,占比2.8%。共有171名患者死亡或发生AIDS事件,280人出现了病毒学失败。
在多因素分析中,研究人员发现,LLV 200-499copies/ml与AIDS/死亡事件5年累计发生率增加显著相关(aHR 2.89,95%CI 1.41-5.92)。
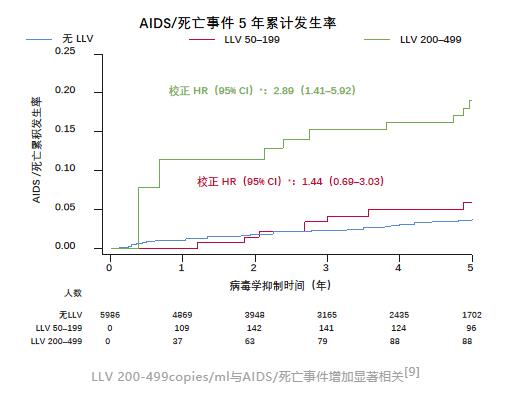 这意味着,LLV确实会对患者的AIDS/死亡事件产生明显的影响。
前不久,在CROI 2020会议上,研究人员公布了另一项关于LLV对临床结局影响的研究[2]。这项关于瑞典全国性队列研究显示了,LLV患者全因死亡率显著增加。
研究人员对启动抗病毒治疗至少6个月后有≥2次VL数据的6956例HIV患者进行了分析,中位随访时间为5.7年。
结果发现,VL介于50-199copies/ml的LLV患者全因死亡率显著增加(HR 2.2, 95%CI 1.3-3.8);VL介于200-999copies/ml的LLV患者严重非AIDS事件风险显著增加(HR 2.1,95%CI 1.2-3.8)。
这意味着,LLV确实会对患者的AIDS/死亡事件产生明显的影响。
前不久,在CROI 2020会议上,研究人员公布了另一项关于LLV对临床结局影响的研究[2]。这项关于瑞典全国性队列研究显示了,LLV患者全因死亡率显著增加。
研究人员对启动抗病毒治疗至少6个月后有≥2次VL数据的6956例HIV患者进行了分析,中位随访时间为5.7年。
结果发现,VL介于50-199copies/ml的LLV患者全因死亡率显著增加(HR 2.2, 95%CI 1.3-3.8);VL介于200-999copies/ml的LLV患者严重非AIDS事件风险显著增加(HR 2.1,95%CI 1.2-3.8)。
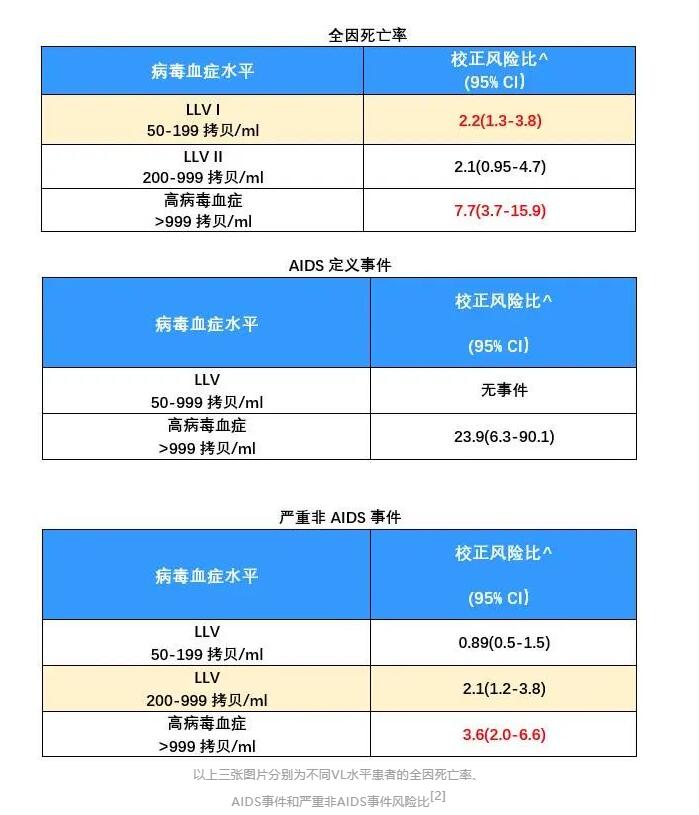 以上研究都用数据证实了一个结果:LLV对患者的临床结局产生了不良的影响。
2012年,为了调查LLV是否与严重非AIDS疾病(心血管病、慢性肾功能衰竭、肝纤维化、肝硬化)独立相关,荷兰的研究人员进行了一项队列研究[9]。
本研究纳入的HIV感染者是来源于荷兰雅典娜国家观察性(ATHENA)HIV临床队列,该队列共由17327名患者组成的。其中6440例HIV感染者符合本研究入组条件:他们在接受了48周的HAART后,病毒都得到了抑制(VL<50copies/mL)。
整体而言,在随访的24603人年中,患者心血管事件总发生率为0.42/100人年(95%CI 0.35-0.51),慢性肾功能衰竭为0.49/100人年(95%CI 0.37-0.64),肝纤维化/肝硬化为0.29/100人年(95%CI 0.23-0.37)。
为了突出显示不同水平阶段的VL对严重非AIDS疾病的影响,研究人员又进行了进一步分析。
结果显示,与病毒抑制者相比,VL>400copies/mL仅与心血管疾病风险较高独立相关。而间歇性病毒血症和VL介于50–400 copies/mL者与非AIDS疾病无关。
VL>400copies/mL的患者与VL≤400copies/mL的患者相比,心血管疾病、肾损伤、肝纤维化/肝硬化的相对风险分别是1.32(95% CI 1.01-1.73)、1.13(95% CI 0.66-1.92)、0.86(95% CI 0.51-1.44)。
以上研究都用数据证实了一个结果:LLV对患者的临床结局产生了不良的影响。
2012年,为了调查LLV是否与严重非AIDS疾病(心血管病、慢性肾功能衰竭、肝纤维化、肝硬化)独立相关,荷兰的研究人员进行了一项队列研究[9]。
本研究纳入的HIV感染者是来源于荷兰雅典娜国家观察性(ATHENA)HIV临床队列,该队列共由17327名患者组成的。其中6440例HIV感染者符合本研究入组条件:他们在接受了48周的HAART后,病毒都得到了抑制(VL<50copies/mL)。
整体而言,在随访的24603人年中,患者心血管事件总发生率为0.42/100人年(95%CI 0.35-0.51),慢性肾功能衰竭为0.49/100人年(95%CI 0.37-0.64),肝纤维化/肝硬化为0.29/100人年(95%CI 0.23-0.37)。
为了突出显示不同水平阶段的VL对严重非AIDS疾病的影响,研究人员又进行了进一步分析。
结果显示,与病毒抑制者相比,VL>400copies/mL仅与心血管疾病风险较高独立相关。而间歇性病毒血症和VL介于50–400 copies/mL者与非AIDS疾病无关。
VL>400copies/mL的患者与VL≤400copies/mL的患者相比,心血管疾病、肾损伤、肝纤维化/肝硬化的相对风险分别是1.32(95% CI 1.01-1.73)、1.13(95% CI 0.66-1.92)、0.86(95% CI 0.51-1.44)。
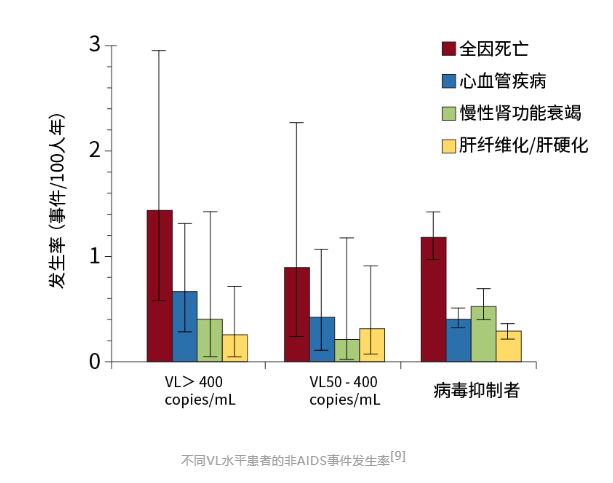 此研究显示,高水平的LLV(VL>400copies/ml)与心血管疾病发生风险增加独立相关。
而另一项意大利多中心、动态队列研究也同样观察到类似结果 [10]。研究人员共纳入了3271例HIV感染者,中位随访时间为4.1年。结果发现,与病毒学持续抑制者相比,血浆VL>500copies/mL的患者中>15%的人全因死亡风险增加了一倍。
综上所述,LLV者确实会出现免疫重建不良的情况,且与病毒学抑制者相比,LLV者更容易发展至AIDS阶段或引发非AIDS相关疾病,从而增加死亡率。
通过我们之前推送的文章可知,即使规范化抗病毒治疗后,仍有1/5至1/3的HIV感染者会出现LLV。并且LLV者的病毒学失败和耐药风险增加。
本期的文章也说明了LLV会对免疫和临床结局产生不良影响。考虑到LLV各种潜在危害,我们应该对LLV提高警惕,切不可掉以轻心。
以上就是本期LLV文章的主要内容,下一期文章中,我们将跟大家探讨HIV低病毒血症对HIV传播的影响,请继续关注。
此研究显示,高水平的LLV(VL>400copies/ml)与心血管疾病发生风险增加独立相关。
而另一项意大利多中心、动态队列研究也同样观察到类似结果 [10]。研究人员共纳入了3271例HIV感染者,中位随访时间为4.1年。结果发现,与病毒学持续抑制者相比,血浆VL>500copies/mL的患者中>15%的人全因死亡风险增加了一倍。
综上所述,LLV者确实会出现免疫重建不良的情况,且与病毒学抑制者相比,LLV者更容易发展至AIDS阶段或引发非AIDS相关疾病,从而增加死亡率。
通过我们之前推送的文章可知,即使规范化抗病毒治疗后,仍有1/5至1/3的HIV感染者会出现LLV。并且LLV者的病毒学失败和耐药风险增加。
本期的文章也说明了LLV会对免疫和临床结局产生不良影响。考虑到LLV各种潜在危害,我们应该对LLV提高警惕,切不可掉以轻心。
以上就是本期LLV文章的主要内容,下一期文章中,我们将跟大家探讨HIV低病毒血症对HIV传播的影响,请继续关注。










